2020年11月25日,国家药品监督管理局公示《关于发布医疗器械注册人开展产品不良事件风险评价指导原则的通告》(2020年第78号),旨在落实《医疗器械不良事件监测和再评价管理办法》(国家市场监督管理总局 国家卫生健康委员会令 第1号)有关要求,规范并指导医疗器械注册人开展医疗器械上市后风险评价工作。原文如下:

为帮助您更好的理解指导原则,小编已为您梳理出重点内容:
一、适用范围
二、总体要求
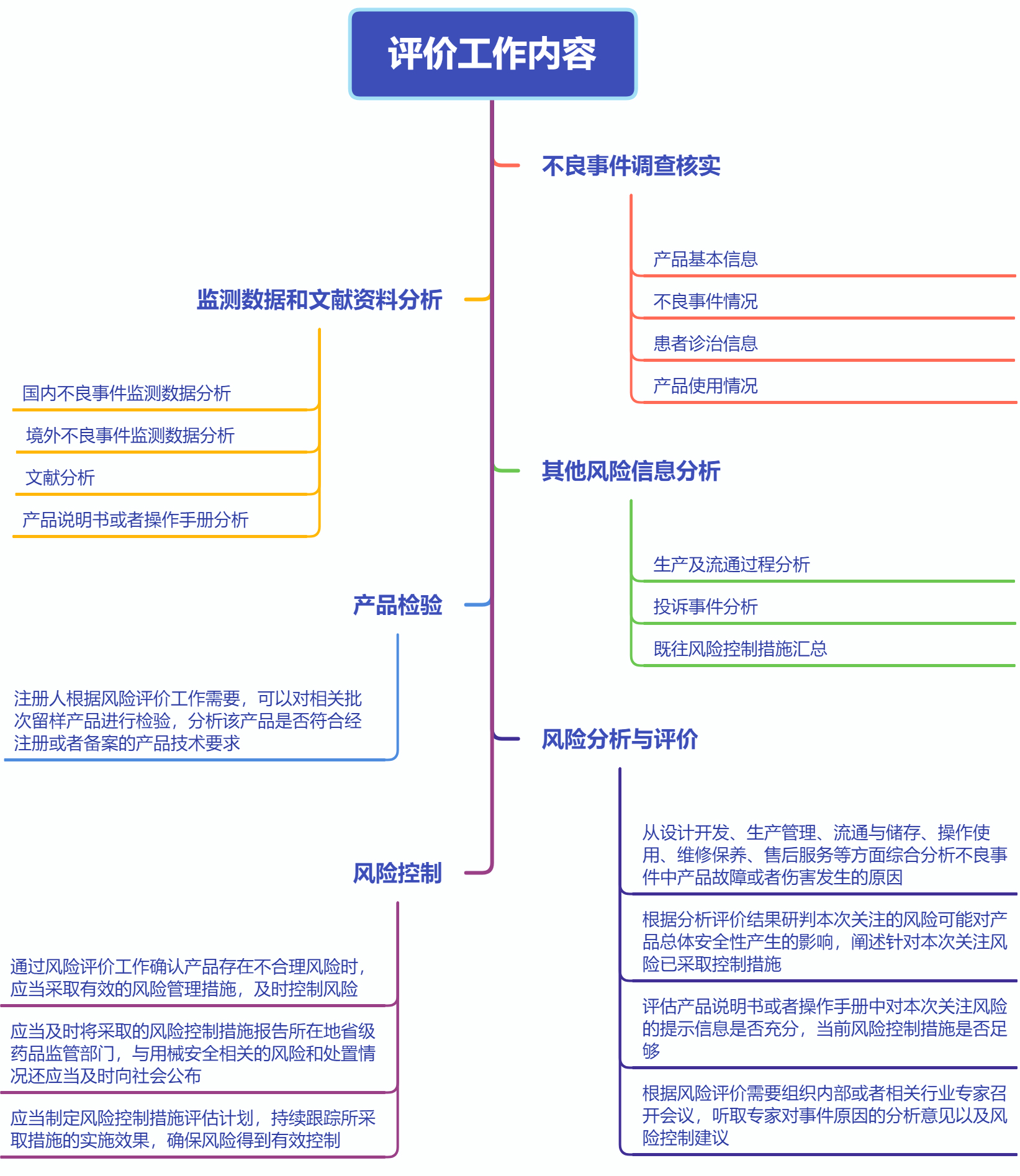
三、评价工作内容
四、评价报告撰写
一般应当包括标题、企业名称、联系地址、邮编、传真,负责产品安全的部门、联系人及联系方式。
一般应当包含二级目录。
包括背景介绍、不良事件调查核实情况、监测数据和文献资料分析情况、其他风险信息情况、产品检验结果、风险分析与评价结论、风险控制措施情况等。
评价报告涉及的关键资料应当作为报告附件一并提交。
五、评价报告提交
六、封面页参考格式和报告正文参考格式
(产品名称)风险评价报告
| ||
企业名称:
|
| |
联系地址:
|
| |
邮编:
|
| |
传真:
|
| |
负责产品安全的部门:
|
| |
联系人:
|
| |
手机:
|
| |
固定电话:
|
| |
电子邮箱:
|
| |
报告完成时间:
|
年 月 日
| |
(产品名称)风险评价报告
1.背景介绍(简要说明本次风险评价的基本情况,阐明开展评价的原因、拟评价的风险以及评价过程中开展的相关工作)
2.不良事件调查核实情况
2.1产品基本信息
2.2不良事件情况
2.3患者诊治信息
2.4产品使用情况
3.监测数据和文献资料分析情况
3.1国内不良事件监测数据分析
3.2国(境)外不良事件监测数据分析
3.3文献资料分析
3.4产品说明书或者操作手册分析
4.其他风险信息情况
4.1生产及流通过程分析
4.2投诉事件分析
4.3既往风险控制措施汇总
5.产品检验结果
6.风险分析与评价结论
7.风险控制
原文链接:https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20201127173533191.html
【原文来源】国家药品监督管理局
【全文整理】苏州大学卫生与环境技术研究所
【声明】如果您认为我们的内容或来源标注与原文不符,请告知我们,我们将与您积极协商解决。谢谢大家的关注。