《科普系列》专题是小编根据16886系列标准精心打磨,用心锤炼而来,旨在帮助大家更全面准确地理解标准的内容。请大家多多支持哦!动动您发财的小手指, 点赞+
点赞+ 收藏+
收藏+ 关注+
关注+ 在看!小编在这预祝您牛年大吉大利!
在看!小编在这预祝您牛年大吉大利!![]()

本标准的主要目的是保护人类由于使用医疗器械所产生的潜在生物学风险, 标准综合了多个关于医疗器械生物学评价的国际标准、国家标准和指南,可作为医疗器械风险管理过程(各种医疗器械总体评价和开发过程的一个组成部分)中进行生物学评价的指导性文件。本标准采用对所有来源的已有数据进行评审与必要时选择补充试验相结合的方式,对各医疗器械的使用安全性进行全面的生物学评价。
生物学危害的范围既广又复杂,在考虑组织与组成材料的相互作用时,不能决然脱离开器械的总体设计。因此,在一个器械的设计中,在组织作用方面最好的材料未必能使器械有好的性能,材料与组织间的作用仅是在选择材料时要考虑的特性之一。生物学评价需涉及的是,在执行器械功能时材料预期与组织间的相互作用。
生物学试验一般基于体外和半体外试验方法以及动物模型,不能完全断定在人体内也出现同样的反应。因此只能以警示的方式判断器械用于人体时的预期作用。另外,个体间对同种材料反应方式的差异性表明,即使是已证实是好的材料,也会有一些患者产生不受反应。因此,对医疗器械进行风险管理过程中的评价与试验十分重要。本标准主要为医疗器械生物学评价提供框架和思路,但绝不是硬性规定一套方法,应结合考虑器械的全部相关因素、具体应用、科学文献评审以及以前的临床经验,围绕风险管理的理念进行全面评价。
那么风险管理过程中的评价与试验到底讲了什么呢?小编已为您梳理出重点内容:
一、GB/T 16886.1-2011风险管理过程中的评价与试验重要术语和定
 医疗器械:
医疗器械:
制造商的预期用途是为下列一个或多个特定目的用于人类的, 不论单独使用或组合使用的仪器、设备、器具、机器、用具、植人物、体外试剂或校准物、软件、材料或者其他相似或相关物品;
 材料:
材料:
任何用于器械及其部件的合成或天然的聚合物、金属、合金、陶瓷或其他无活性的物质,包括无活性的组织;
 最终产品:
最终产品:
由制造商技术规范或标签中明确的“使用” 状态的医疗器械;
 化学成分:
化学成分:
材料和(或)医疗器械制造过程中使用的任何合成的或天然的物质,如添加剂(抗氧化剂、uV稳定剂、着色剂等)、加工助剂(溶剂、润滑剂、消泡剂等);
 数据组:
数据组:
用以表征器械生物学反应所需的各种来源的信息。
二、医疗器械生物学评价基本原则学评价基本原则
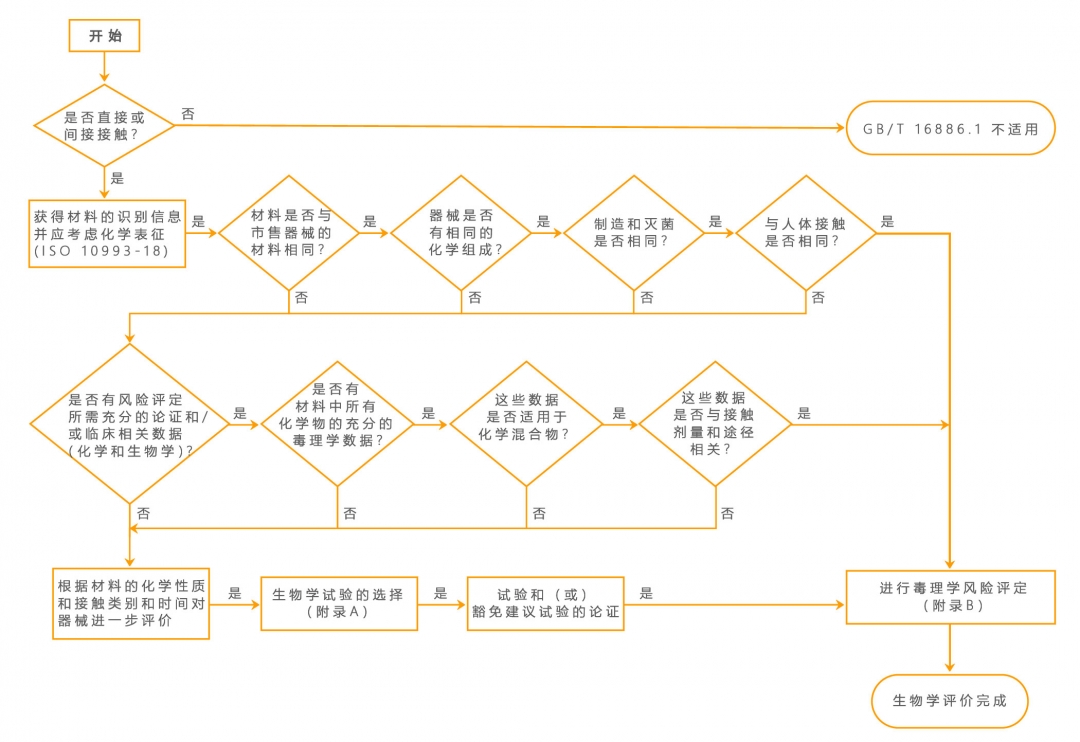
 预期用于人体的任何材料或器械的选择和评价应是按ISO14971开展的风险管理过程中生物学评价程序的组成部分(如图1所示);评价程序应包括以文件形式发布的决定,评定下列方面的优缺点和适宜性等:
预期用于人体的任何材料或器械的选择和评价应是按ISO14971开展的风险管理过程中生物学评价程序的组成部分(如图1所示);评价程序应包括以文件形式发布的决定,评定下列方面的优缺点和适宜性等:
➢各种候选材料的物理特性和化学特性;
➢任何临床使用史或人体接触数据;
➢产品和组成材料、 裂解产物和代谢物的任何现有的毒理学和其他生物学安全性数据;
➢试验程序。
 在选择制造器械所用材料时, 应首先考虑材料特性对其用途的适宜性, 包括化学、 毒理学、 物理学、电学、 形态学和机械等性能;
在选择制造器械所用材料时, 应首先考虑材料特性对其用途的适宜性, 包括化学、 毒理学、 物理学、电学、 形态学和机械等性能;
 器械总体生物学评价应考虑以下方面:
器械总体生物学评价应考虑以下方面:
➢造所用材料;
➢预期的添加剂、工艺污染物和残留物;
➢可沥滤物质;
➢降解产物;
➢其他组件及其在最终产品中的相互作用;
➢最终产品的性能与特点;
➢最终产品的物理特性,包括但不限于:多孔性、颗粒大小、形状和表面形态。
 在选择生物学评价所需的试验和数据以及对其进行解释时, 应考虑材料的化学成分,包括接触条件和该医疗器械及其组件与人体接触的性质、程度、频次和时间,以便于确定器械的类别并选择适宜的试验;
在选择生物学评价所需的试验和数据以及对其进行解释时, 应考虑材料的化学成分,包括接触条件和该医疗器械及其组件与人体接触的性质、程度、频次和时间,以便于确定器械的类别并选择适宜的试验;
 对每种材料和最终产品都应考虑所有潜在的生物学危害,但这并不意味着所有的潜在危害试验都是必需的或可操作的;
对每种材料和最终产品都应考虑所有潜在的生物学危害,但这并不意味着所有的潜在危害试验都是必需的或可操作的;
 所有体外或体内试验都应根据最终使用来选择;
所有体外或体内试验都应根据最终使用来选择;
 在下列任一情况下, 应对材料或最终产品重新进行评价:
在下列任一情况下, 应对材料或最终产品重新进行评价:
➢制造产品所用材料来源或技术规范改变时;
➢产品配方、工艺、初包装或灭菌改变时;
➢涉及贮存的制造商使用说明书或要求的任何改变, 如贮存期和(或)运输改变时;
➢产品预期用途改变时;
➢有证据表明产品用于人体后出现了不良反应时。
 生物学评价应结合制造器械所用材料成分的性质及其变动性、 其他非临床试验、 临床研究以及上市后情况进行总体评定。
生物学评价应结合制造器械所用材料成分的性质及其变动性、 其他非临床试验、 临床研究以及上市后情况进行总体评定。
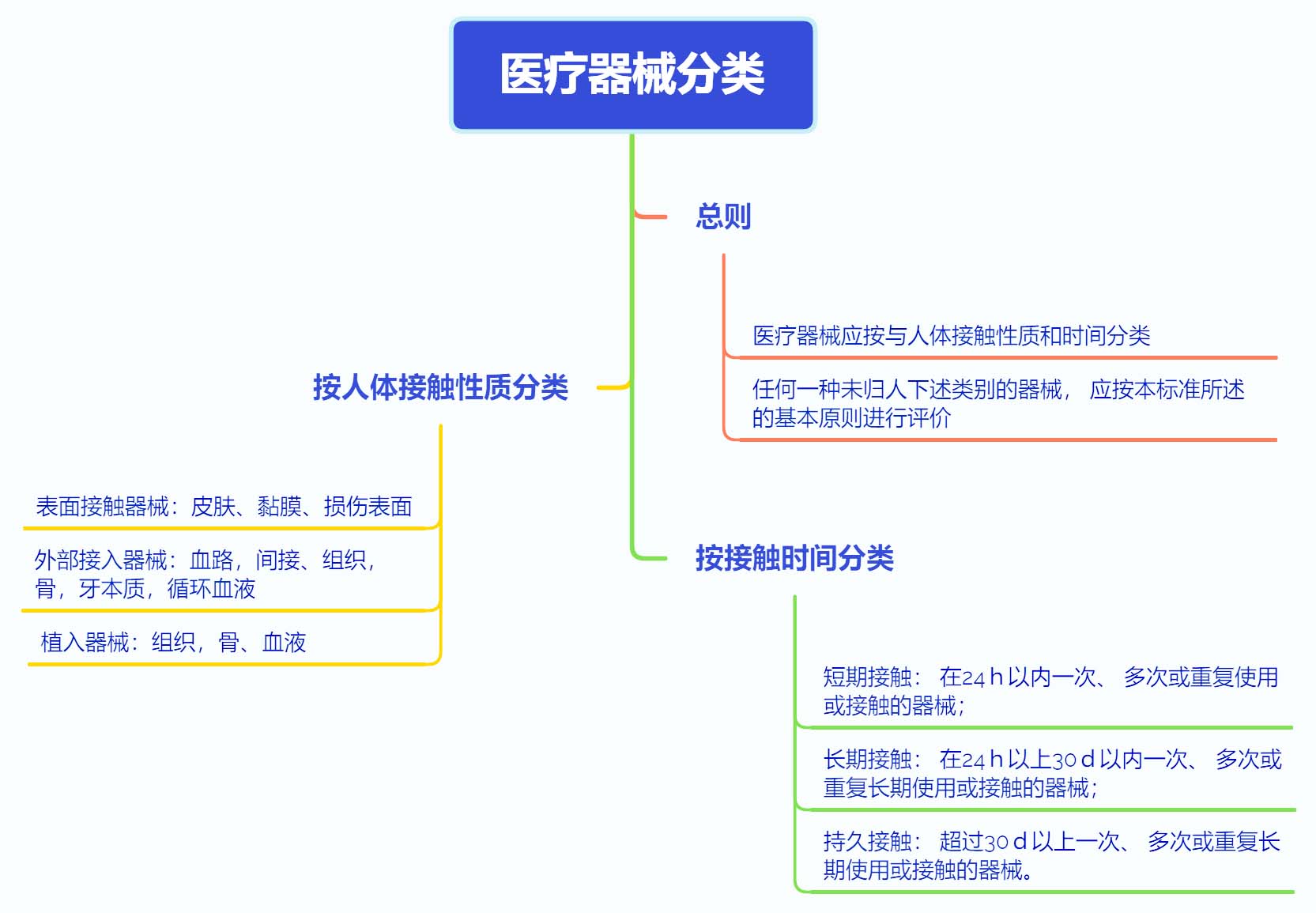
三、医疗器械分类
四、生物学评价过程
 材料表征
材料表征
➢生物学评价过程中的材料表征是至关重要的第一步;
➢对于已知具有与预期剂量相关毒理学数据、 并且接触途径和接触频次显示有足够安全限度的器械溶出物和可沥滤物,很少需要进一步试验,或不必再进行试验;
➢如果一个特定化学物的溶出物总量超出了安全限度, 应采用相应的模拟临床接触的浸提液试验来确立临床接触该化学物的速率,并估计总接触剂量;
➢风险评定的结果还会得出需要增加对材料进行表征的结论;
➢在器械的制造、灭菌、运输、贮存和使用条件下有潜在降解时,应按ISO 10993-9、ISO 10993-13、ISO10993-14和ISO10993-15对降解产物的存在与属性进行表征。
 生物学评价试验
生物学评价试验
➢总则:对所有现有的合理并适用的信息进行分析,并与器械生物学安全性分析所需的数据组进行比较。识别风险评定完整数据组需要补充的其他数据或试验。
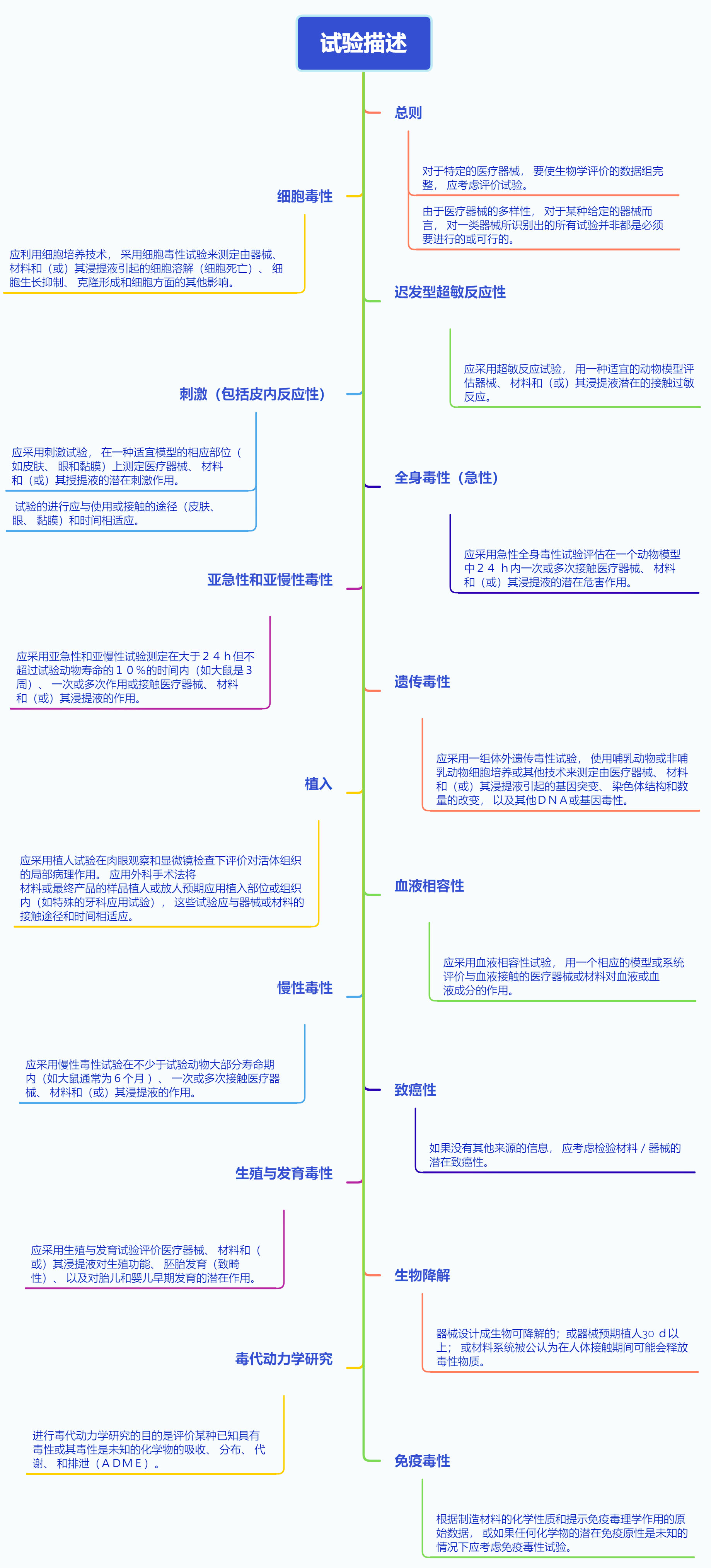
➢试验描述
五、生物学评价数据的解释和生物学安全性总体评定
 具有必要的理论知识和实践经验的评价专家应确定以下方面并形成文件:
具有必要的理论知识和实践经验的评价专家应确定以下方面并形成文件:
➢医疗器械生物学评价的策略和程序内容;
➢确定材料和预期目的在风险管理计划范畴内的可接受性准则;
➢材料表征的适当性;
➢选择和(或)豁免试验的说明;
➢已有数据和试验结果的解释,
➢完成生物学评价所需的其他数据;
➢医疗器械总体生物学安全性的结论。
【原文来源】GB/T 16886.2-2011
【全文整理】苏州大学卫生与环境技术研究所
【声明】如果您认为我们的内容或来源标注与原文不符,请告知我们,我们将与您积极协商解决。谢谢大家的关注。