现行医疗器械生物学评价国家标准GB/T 16886中的部分标准落后于国际系列标准。近日,全国医疗器械生物学评价标准化技术委员会(以下简称技委会)归口制修订的4项国家标准、1项国家标准化指导性技术文件、1项行业标准发布征求意见稿。
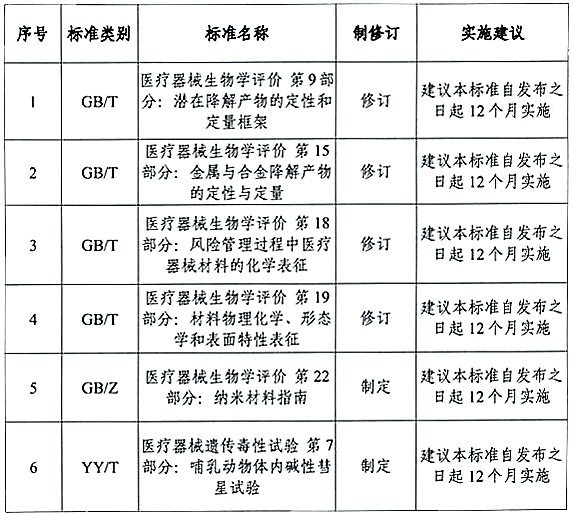
其中,4项国家标准的征求意见稿等同采用对应的ISO 10993标准,GB/Z 16886.22《医疗器械生物学评价 第22部分:纳米材料指南》征求意见稿等同采用 ISO/TR 10993-22:2017。小编已将修订标准的主要技术变化,以及新制定标准的重点内容梳理如下,敬请查阅???:
《医疗器械生物学评价 第9部分:潜在降解产物的定性和定量框架》征求意见稿
a.“生物降解”修订为“降解”;
b.考虑纳米材料和相关材料的特定标准,修订测试方法信息(见第4章,2017 版的第4章)。
《医疗器械生物学评价 第15部分:金属与合金降解产物的定性与定量》征求意见稿
a.范围增加了“本文件适用于预期在体内降解的材料以及非预期降解的材料”的描述(见第1章,2003年版的第1章);
b.增加了纳米材料和其他相关材料的试验方法的信息(见4.1,2003年版的4.1);
c.增加了更多试验溶液(电解质)(见5.2,2003年版的5.2);
d.增加了更多样品形状(见5.3.3,2003年版的5.3.3);
e.增加了浸泡试验的具体内容(见第7章,2003年版的第7章);
f.将附录C调整为附录A,附录A调整为附录B,附录B调整为附录C(见附录A、附录B、附录C,2003年版的附录C、附录A、附录B)。
《医疗器械生物学评价 第 18 部分:风险管理过程中医疗器械材料的化学表征》征求意见稿
a.进一步融合和协调了GB/T 16886.1、GB/T 16886.12 与 GB/T 16886.17(见 5.1,2011 年版第5章);
b.更改了化学表征流程图(见图1、图2、图3、图4,2011年版附录 A 中图 A.1);
c.增加了对分析试验的描述,强调分析试验不是必需的(见 5.1、5.2、附录B);
d.增加了若干定义(例如,医疗器械构造、制造材料、材料组成)(见第3章);
e.增加了化学表征独有的试验方法(即,用于危险(源)识别的消解和溶解试验方法)(见3.12、3.13、6.1、附录D);
f.增加了与分析方法认定相关考虑事项的讨论(见附录F);
g.增加了关于一般原则、浸提介质考虑事项和分析评价阈值(AET;低于该浓度阈值时,无需进行可浸提物或可沥滤物的定性)的资料性附录(见附录A、附录D、附录E)。
《医疗器械生物学评价 第 19 部分:材料物理化学、形态学和表面特性表征》征求意见稿
a.增加了“方法学缩略语”的内容(见表A.1,2011年版的表 1);
b.增加“表征参数和方法举例”的内容,将2011版的表2分为两个表:一个列出典型方法,另一个列出其他方法(即较少使用的方法)(见表 A.2 和表 A.3,2011 年版的表 2);
c.增加了GB/T 16886.18-20XX 附录C的材料等同性相关内容(见 5.3 和附录 A);
d.增加了ISO/TR 10993-22 的纳米材料信息(见5.3和表A.3)。
GB/Z 16886.22《医疗器械生物学评价 第22部分:纳米材料指南》征求意见稿
本文件等同采用ISO/TR10993-22:2017《医疗器械生物学评价 第22部分:纳米材料指南》。
本文件旨在为包含、产生或由纳米材料组成的医疗器械生物学评价提供指南。本文件规定了由纳米材料组成或包含纳米材料的医疗器械的生物学评价的考虑因素,以及在医疗器械(或组件)生产过程中未使用纳米材料,但其降解、磨损或在机械处理过程中(如医疗器械原位研磨、抛光等)产生的纳米物体的评价。
本文件旨在提供一个通用框架,并重点介绍在评定由纳米物体组成、包含和/或产生纳米物体的医疗器械的安全性时需要考虑的重要方面。此外,本文件还指出了与块体材料或小分子化学物质相比,测试纳米材料时发现的几个常见的未预料到的困难和障碍。作为技术指导性文件(GB/Z),本文件代表了与纳米材料相关的当前技术知识,没有列出或提供详细的试验方案。本文件可以作为聚焦于包含纳米材料测试详细方案的未来文件的基础。
YY/T 0870.7《医疗器械遗传毒性试验 第 7 部分:哺乳动物体内碱性彗星试验》征求意见稿
YY/T 0870旨在建立医疗器械遗传毒性的具体试验方法,拟由7个部分构成,本标准可作为 GB/T 16886.3 中遗传毒性试验的补充方法标准。
GB/T 16886.3中给出的检测潜在遗传毒性物质的试验方法2均为经济合作与发展组织(OECD)《化学品测试指南》中规定的方法,这些方法是针对化学品的特性制定而成,同时未给出详细的试验步骤,因此不适宜直接用于医疗器械/材料的检测。本标准根据医疗器械/材料的特性规定了详细的试验步骤,可作为 GB/T 16886.3 中遗传毒性试验的补充方法标准。
扫码查看原文:

原文来源:国家药品监督管理局
原文整理:苏州大学卫生与环境技术研究所
声明:如果您认为我们的内容或来源标注与原文不符,请告知我们,我们将与您积极协商解决。谢谢大家的关注!