原创
摘要:MDCG 2023-6无预期医疗目的产品等同性论证指南
合集:#欧盟MDR法规合集
近日,MDCG发布了MDCG 2023-6 MDR附录XVI中的产品等同性论证指南。
简介
MDR规定在符合性评估所要求的器械临床评估中,可以使用等同器械相关的临床数据。
虽然进行临床调查是获得与有关器械安全性和性能的临床数据最直接的办法,但也可根据MDR要求证明与相关器械等同的器械数据作为临床数据。
EU 2022/2346规定了MDR附录XVI所列的无预期医疗用途产品组别的通用规范。根据MDR,如果所有可用的临床研究结果仅与医疗器械有关,则无法证明医疗器械与无预期医疗用途产品之间的等同性。因此需针对无预期医疗用途的产品进行临床研究。
范围
本指南旨在对MDR 附录XVI中列出的无预期医疗用途产品进行CE标识。本指南应与关于等同性的MDCG 2020-5一并使用。
等同性证明
无预期医疗用途产品 VS 无预期医疗用途产品
在参考等同器械的临床数据时,制造商应考虑按照MDR中规定的标准论证两种无预期医疗用途的器械之间的等同性。特别是,论证必须考虑技术、生物学和临床特征。MDR 中列出的技术和生物标准可直接用于比较无预期医疗用途产品的特性。在考虑临床特性标准时,应考虑到其中一些标准是专门针对具有医疗目的的器械。下表阐明了对于没有预期医疗用途的产品应如何考虑这些特性:
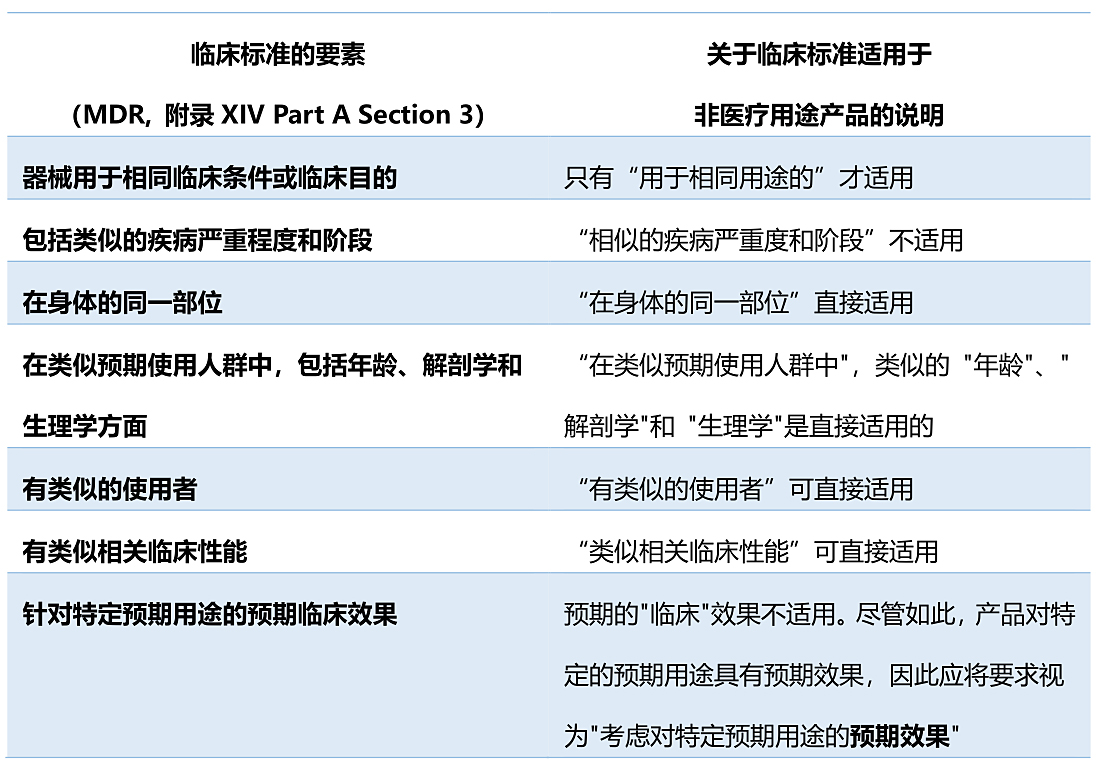
无预期医疗用途产品 VS 类似医疗器械
一般而言,不太可能进行医疗器械和无预期医疗用途产品之间的比较,因为不是所有的临床特征都可进行比较。尤其“类似的疾病严重程度和阶段"这一特征对于医疗器械来说是可定义和获得的,而对于没有预期医疗目的的产品来说则无法定义和获得。因此,在无预期医疗用途的器械和有预期医疗用途的类似产品之间,无法完成和建立等同性证明。
无预期医疗用途产品 VS 两用器械
无预期医疗用途的产品与既有医疗用途又有非医疗用途的器械(两用器械)之间的等同性,可通过比较两种器械与非医疗用途相关的特性来证明。对于两用器械,应仅考虑与非医疗目的相关的特征。如果证明了等同性,在对无预期医疗用途的产品进行临床评价时,应仅使用该两用器械适用于非医疗用途的、与一般安全和性能要求有关的临床数据。
【供 稿】苏大检测医疗器械事业部法规中心



