非原创
摘要:2月NMPA、CMDE等官方机构发布的法规通告汇总
公告
1.【CMDE】关于2024年3月~4月医疗器械注册受理前技术问题咨询工作安排的通告(2024年第9号) - 2024.2.19
为做好医疗器械注册受理前技术问题咨询工作,指导行政相对人安排咨询时间,保证咨询工作质量,现就近期咨询工作安排通告如下:
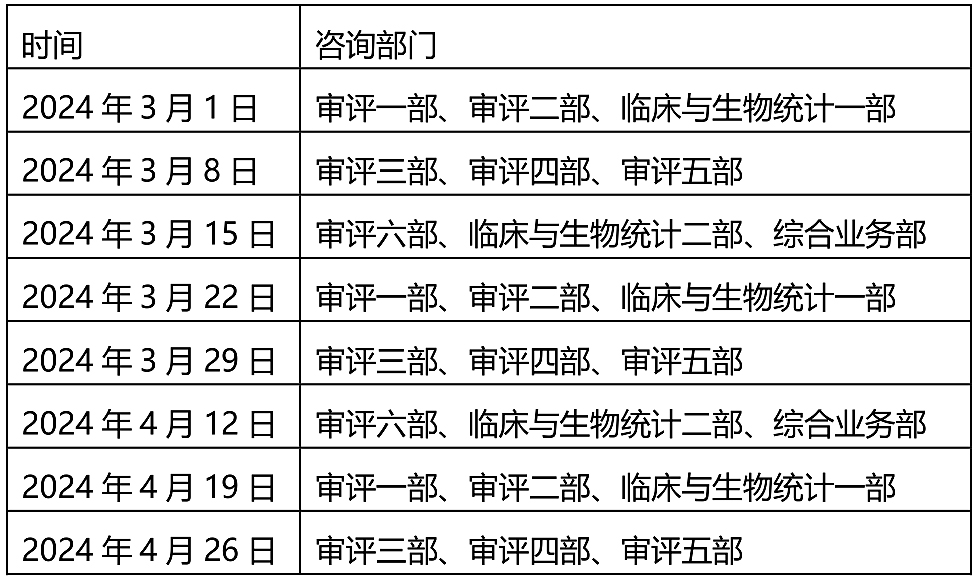
注:受理前咨询工作暂时采用视频会议方式进行,申请人预约成功后请等待电话通知。请申请人按照我中心2022年10月16日发布的《关于医疗器械受理前技术问题咨询工作安排调整的通告》(2022年第37号)的要求申请和办理,各受理前技术问题咨询参与单位咨询时间安排同器审中心,但不受轮值部门限制。
原文链接:关于2024年3月~4月医疗器械注册受理前技术问题咨询工作安排的通告(2024年第9号) (cmde.org.cn)
2.【CMDE】关于发布正电子发射磁共振成像系统等4项医疗器械产品注册审查指导原则的通告(2024年第8号)- 2024.2.6
为规范部分有源产品的注册申报和技术审评,国家药监局器审中心组织制修定了《正电子发射磁共振成像系统注册审查指导原则》等4项注册审查指导原则,现予发布。
特此通告。
原文链接:国家药监局器审中心关于发布正电子发射磁共振成像系统等4项医疗器械产品注册审查指导原则的通告(2024年第8号) (cmde.org.cn)
3.【CMDE】关于发布近视弱视用激光设备技术审评要点的通告(2024年第6号) – 2024.2.6
为进一步规范近视弱视用激光设备的管理,国家药监局器审中心组织制订了《近视弱视用激光设备技术审评要点》,现予发布。
特此通告。
原文链接:国家药监局器审中心关于发布近视弱视用激光设备技术审评要点的通告(2024年第6号) (cmde.org.cn)
4.【CMDE】关于调整医疗器械注册电子申报信息化系统业务范围的通告(2024年第7号)- 2024.2.5
2019年6月24日,医疗器械注册电子申报信息化系统(eRPS)正式启用,业务范围已包括境内第三类和进口第二、三类医疗器械注册、变更注册、变更备案、延续注册、说明书更改告知、创新医疗器械特别审查、注册证及变更文件纠错事项等,启用至今系统运行整体平稳。为进一步推进医疗器械审评审批服务便民化,定于2024年2月6日将自行撤回医疗器械注册申请事项纳入eRPS系统业务范围。同时,为进一步指导注册申请人准备电子版资料,我中心制作了自行撤回医疗器械注册申请申报资料电子目录文件夹结构,现予发布。
特此通告。
原文链接:关于调整医疗器械注册电子申报信息化系统业务范围的通告(2024年第7号) (cmde.org.cn)
5. 【CMDE】发布2023年度医疗器械注册工作报告 – 2024.2.5
2月5日,国家药品监督管理局医疗器械技术审评中心发布2023年度医疗器械注册工作报告,详情见原文链接。
原文链接:2023年度医疗器械注册工作报告 (cmde.org.cn)
6. 【NMPA】发布YY/T 1898—2024《血管内导管导丝亲水性涂层牢固度试验方法》等20项医疗器械行业标准的公告(2024年第16号)-2024.2.19
YY/T 1898—2024《血管内导管导丝亲水性涂层牢固度试验方法》等20项医疗器械行业标准已经审定通过,现予以公布。标准编号、名称、适用范围及实施日期见原文链接。
特此公告。
原文链接:国家药监局关于发布YY 1001—2024《全玻璃注射器》等20项医疗器械行业标准的公告(2024年第16号) (nmpa.gov.cn)
7. 【NMPA】关于批准注册321个医疗器械产品的公告(2024年1月)(2024年第13号) – 2024.2.7
2024年1月,国家药监局共批准注册医疗器械产品321个。其中,境内第三类医疗器械产品247个,进口第三类医疗器械产品41个,进口第二类医疗器械产品33个(具体产品见原文链接)。
特此公告。
原文链接:国家药监局关于批准注册321个医疗器械产品的公告(2024年1月)(2024年第13号) (nmpa.gov.cn)
8. 【NMPA】发布中国医疗器械标准管理年报(2023年度) - 2024.2.1
2月1日,国家要药品监督管理局发布2023年度中国医疗器械标准管理年报,详情参见原文链接。
原文链接:中国医疗器械标准管理年报(2023年度) (nmpa.gov.cn)
征集
主体责任的激励和约束措施管理规定(试行)(征求意见稿)》公开征求意见的公告 – 2024.2.23
为进一步推动药品(含医疗器械、化妆品,下同)研制、生产、经营等单位落实质量安全主体责任,现将我局起草的《江苏省药品监督管理局推动企业落实质量安全主体责任的激励和约束措施管理规定(试行)(征求意见稿)》向社会公开征求意见,公众可通过以下途径和方式提出意见:
1. 通过电子邮件将意见发送至:jsfdafkc@163.com。邮件主题请注明“《江苏省药品监督管理局推动企业落实质量安全主体责任的激励和约束措施管理规定(试行)(征求意见稿)》公开征求意见”字样。
2. 通过信函将意见邮寄至:江苏省南京市鼓楼区鼓楼街5号江苏省药品监督管理局政策法规处,邮政编码:210008。信封上请注明“《江苏省药品监督管理局推动企业落实质量安全主体责任的激励和约束措施管理规定(试行)(征求意见稿)》公开征求意见”字样。
意见反馈截止日期为2024年3月23日。
原文链接:关于《江苏省药品监督管理局推动企业落实质量安全主体责任的激励和约束措施管理规定(试行)(征求意见稿)》公开征求意见的公告 (jiangsu.gov.cn)
求意见稿)》意见的通知 - 2024.2.18
各有关单位:
根据国家药品监督管理局2023年度医疗器械注册审查指导原则制修订计划的有关要求,我中心组织编制了《射频微波消融设备同品种临床评价技术审查指导原则》,经调研、讨论,现已形成征求意见稿(附件1),即日起在网上公开征求意见。
如有意见和建议,请填写意见反馈表(附件2),以电子邮件的形式于2024年3月8日前反馈至我中心相应联系人。邮件主题及文件名称请以“《射频微波消融设备同品种临床评价技术审查指导原则(征求意见稿)》意见反馈+反馈单位名称”格式命名。
联系人:王雅文 刘菁
电 话:010-86452515
电子邮箱:wangyw@cmde.org.cn liuj@cmde.org.cn
原文链接:关于公开征求《射频微波消融设备同品种临床评价注册审查指导原则(征求意见稿)》意见的通知 (cmde.org.cn)



