原创
摘要:欧盟发布MDCG 2024-5,关于研究者手册所需信息内容的介绍。
合集:#欧盟MDR法规合集
当地时间2024年4月17日,医疗器械协调小组发布了MDCG 2024-5,涉及医疗器械临床试验研究者手册(Investigator’s Brochure, IB)相关内容。 本次发布的指南仅针对MDR下的临床试验,对IVDR下的性能研究并不适用。
临床研究申办方应向进行临床研究的成员国提交申请书及研究者手册。本指南基于MDR、ISO 14155:2020要求以及主管机构的经验编制而成,旨在支持申办者制定其IB,更详细地说明IB部分应包含哪些类型的信息,避免主管机构在评估临床研究申请时提出问题,延缓临床研究申请进程。
研究者手册内容
IB应包含与研究相关并在申请时提供的研究器械的临床和非临床信息。若IB内容有变化,应及时更新,并在一星期内通知相关成员国更新内容,此外也应提醒研究者注意IB的任何更新。IB内容应包含行政信息和研究器械相关信息。
行政信息:IB的第一页应明确标识Investigator’s Brochure,此外还应包含研究器械的名称、文件参考号、IB版本和日期、保密声明(如适用)、修订历史摘要和目录。应注明临床研究申办者的名称和地址,研究器械制造商的名称和地址(若与申办者不同),并将IB的每一页注明页码及文件总页数。
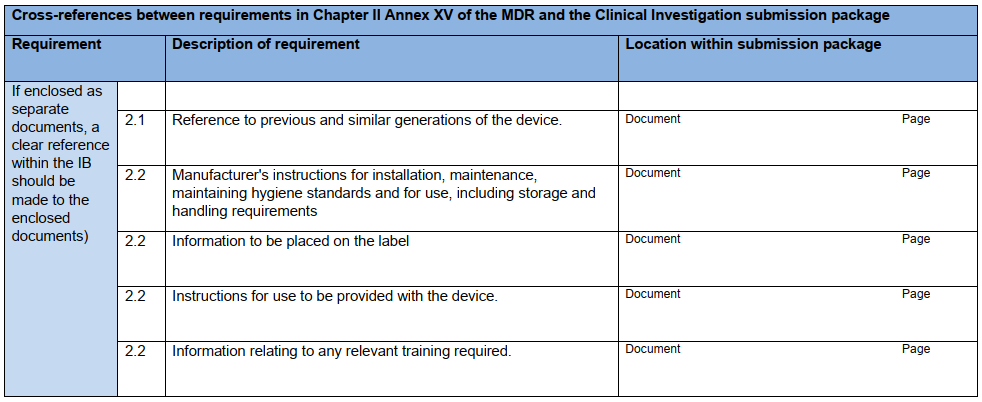
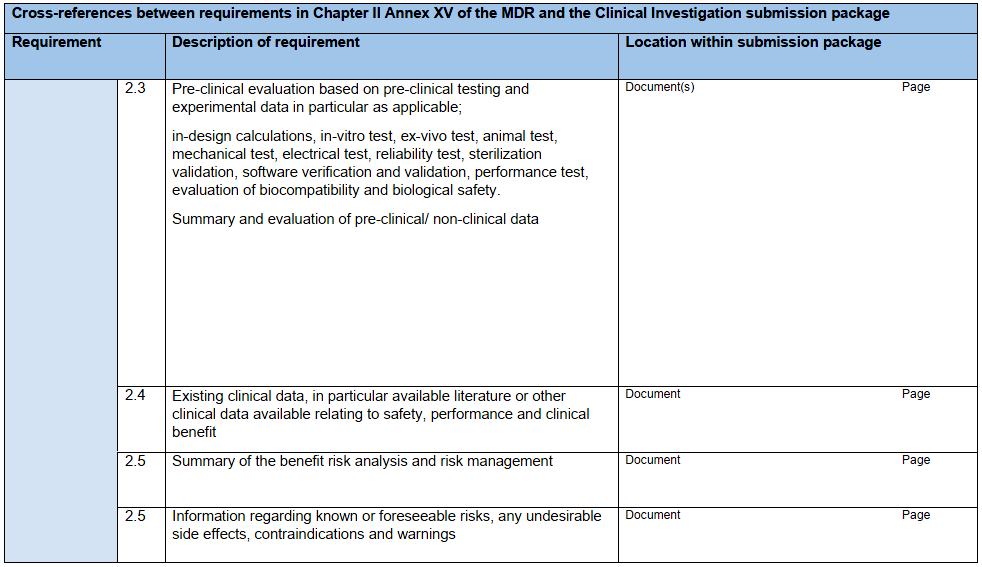
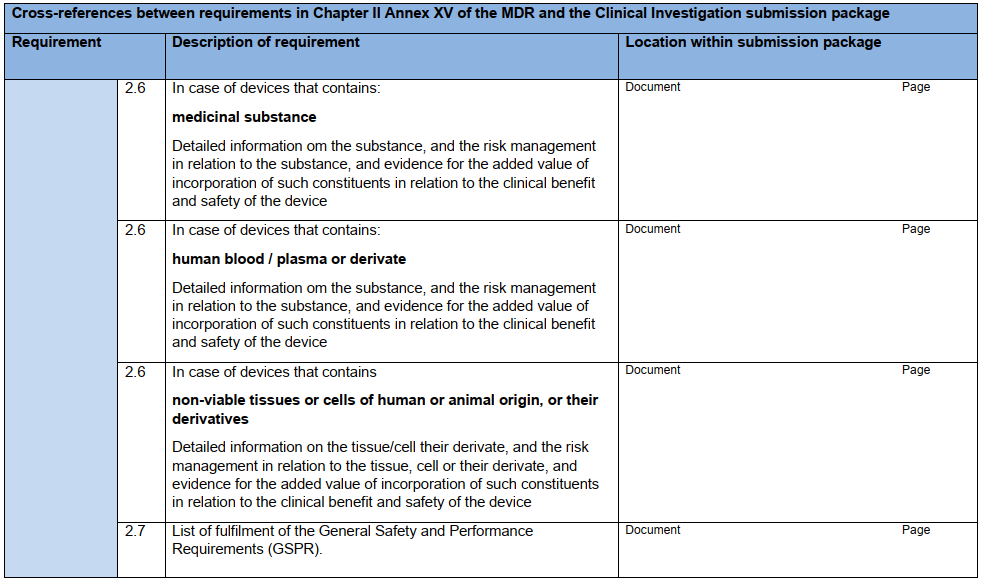
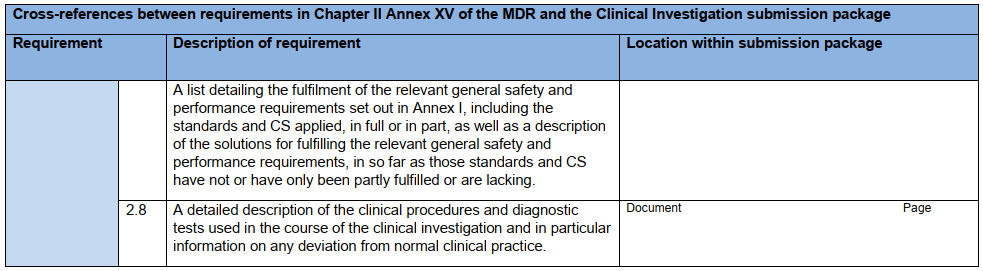
研究器械相关信息:IB应包含研究器械各方面的信息,最低应达到本指南附录A核查表中列出的信息。若使用此核查表,则应将其与IB一起提交给主管机构。
核查表

参考资料: MDCG 2024-5 – Guidance on the Investigator’s Brochure content
【供 稿】苏大检测医疗器械事业部法规中心



