非原创
摘要:6月NMPA、CMDE等官方机构发布的法规通告汇总
公告
依据国家药品监督管理局《创新医疗器械特别审查程序》(国家药监局2018年第83号公告)要求,创新医疗器械审查办公室组织有关专家对创新医疗器械特别审查申请进行了审查,拟同意以下申请项目进入特别审查程序,现予以公示。
产品名称:磁共振成像系统
申 请 人:西门子医疗有限公司
公示时间:2024年6月20日至2024年7月4日
公示期内,任何单位和个人有异议的,可以书面、电话、邮件等方式向我中心综合业务部反映。
联 系 人:张欣
电话:010-86452928
电子邮箱:gcdivision@cmde.org.cn
地址:北京市海淀区气象路50号院1号楼
原文链接:创新医疗器械特别审查申请审查结果公示(2024年第6号) (cmde.org.cn)
为做好医疗器械注册受理前技术问题咨询工作,指导行政相对人安排咨询时间,保证咨询工作质量,现就近期咨询工作安排通告如下:
一、轮值部门时间安排:
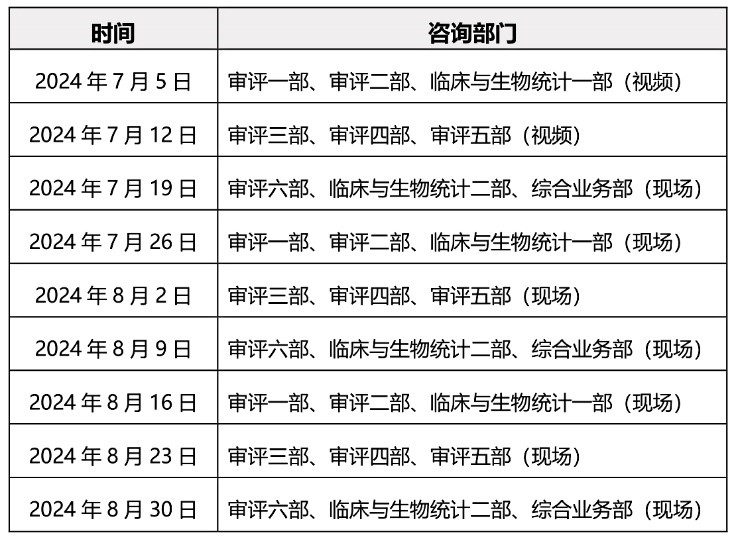
二、2024年7月1日器审中心正式在新址恢复办公,为确保受理前咨询工作顺
利平稳过渡,7月5日和7月12日两期受理前技术问题咨询工作仍采用视频会议方式进行,申请人预约成功后,请等待电话通知获取视频会议时间及登录方式。
三、自2024年7月19日起,受理前技术问题咨询恢复为现场咨询,预约方式
不变,按照中心2022年10月16日发布的《关于医疗器械受理前技术问题咨询工作安排调整的通告》(2022年第37号)的要求申请和办理。未预约现场咨询或预约未成功的单位,仍可选择邮件方式提交咨询申请。各受理前技术问题咨询参与单位咨询时间安排同器审中心,但不受轮值部门限制。
咨询时间:工作日每周五下午13:30至16:30(法定节假日除外)。
咨询地点:北京经济技术开发区广德大街22号院一区2号楼一层。
原文链接:关于2024年7月~8月医疗器械注册受理前技术问题咨询工作安排的通告(2024年第22号) (cmde.org.cn)
为进一步规范中医脉诊设备产品等医疗器械的管理,国家药监局器审中心组织制修订了《中医脉诊设备产品注册审查指导原则》等20项医疗器械注册审查指导原则(见附件),现予发布。
特此通告。
原文链接:国家药监局器审中心关于发布中医脉诊设备产品等20项医疗器械注册审查指导原则的通告(2024年第21号) (cmde.org.cn)
为进一步规范医疗器械强制性标准的适用范围,器审中心在2022年已发布《医疗器械产品适用强制性标准清单》(2022年第42号)(以下简称“清单”)的基础上,根据医疗器械强制性国家标准和强制性行业标准制修订情况,经商国家药品监督管理局医疗器械标准管理中心,对清单进行了修订。
现将修订后的文件予以发布,自发布之日起,《医疗器械产品适用强制性标准清单》(2022年第42号)同时废止。
特此通告。
原文链接:关于发布医疗器械产品适用强制性标准清单(2024年修订版)的通告(2024年第20号) (cmde.org.cn)
2024年5月,国家药监局共批准注册医疗器械产品265个。其中,境内第三类医疗器械产品197个,进口第三类医疗器械产品40个,进口第二类医疗器械产品27个,港澳台医疗器械产品1个(具体产品见附件)。
特此公告。
原文链接:国家药监局关于批准注册265个医疗器械产品的公告(2024年5月)(2024年第74号) (nmpa.gov.cn)



