为鼓励创新医疗器械的发展,FDA设立了突破性器械认定(Breakthrough Device Designation, BDD)和更安全技术计划(Safer Technologies Program, STeP),旨在确保患者能够获得更多高质量、安全的治疗机会。通过BDD和STeP的产品可以进行优先审评,进一步缩短研发、上市的时间。本文小编将从认定对象、认定标准、申请流程、利好政策及获批数据情况五方面对两项计划进行介绍。
突破性器械认定(BDD)
突破性医疗器械认定(Breakthrough Device Designation, BDD)是FDA 2018年设立的一项针对创新器械的加速上市程序,旨在帮助罹患重大不可逆疾病的患者获得更多治疗机会。
BDD对象
器械或以器械为主的组合产品。
BDD标准及申请流程
申请人可在提交器械上市申请前的任何时间申请BDD,认定标准及申请流程参阅下图:

BDD标准符合性论证要点
BDD利好政策
获批BDD后,申请人可通过多种方式获得器械开发的反馈意见,包括冲刺讨论(sprint discussions)、数据开发计划讨论、临床试验方案讨论。此外,申请人还将在今后提交的器械监管申请中获得优先审评,包括Q-Submission、IDE申请和上市申请,进一步缩短研发、上市时间。
BDD获批数据情况
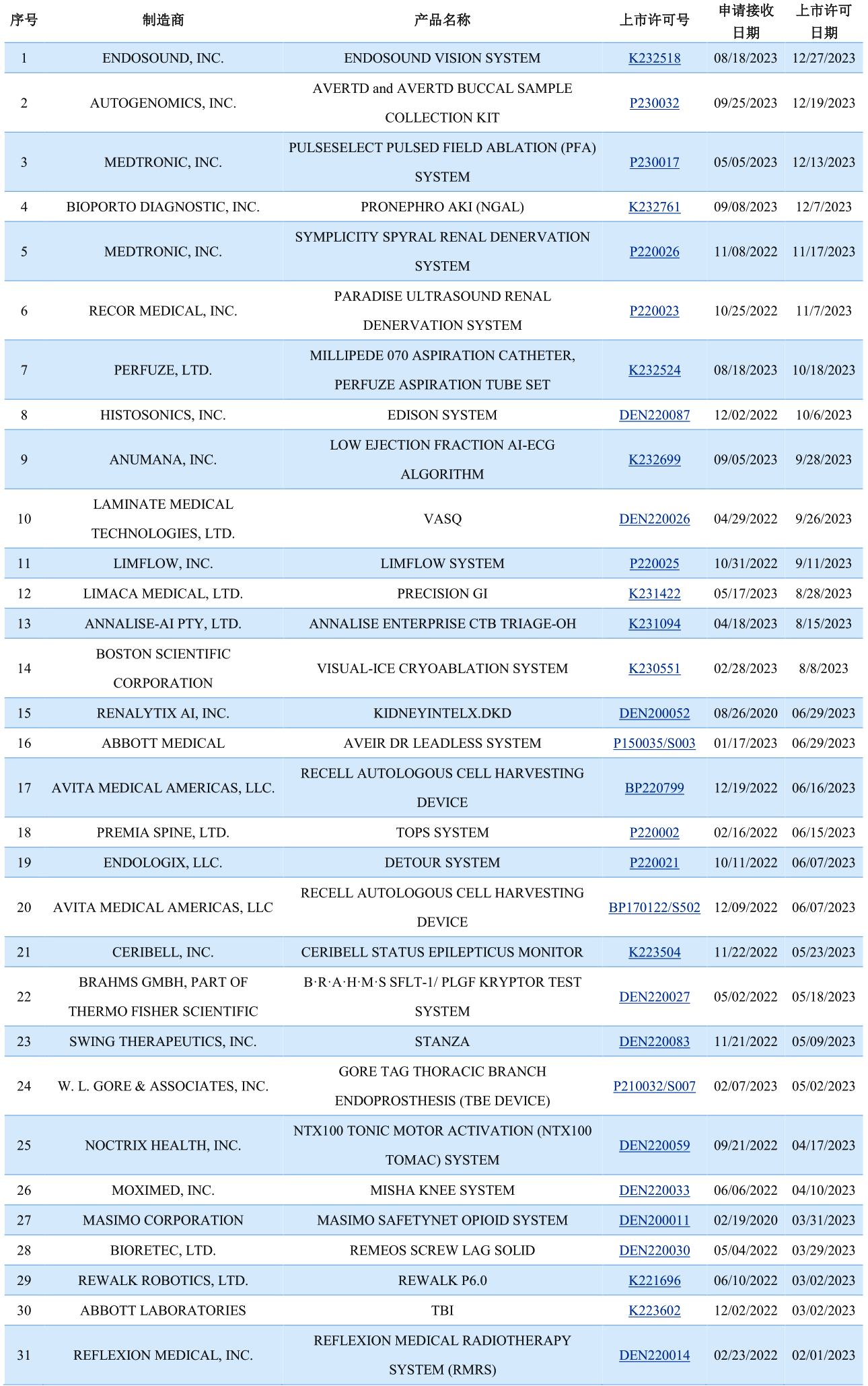
截至2023年12月31日,共计933款器械获批BDD(之前通过EAP计划纳入的器械也计算在内),其中的95款获得上市许可。在获得上市许可之前,FDA不会公开披露BDD申请情况和该申请的批准情况。以下为FDA官网列示的2023年已获得上市许可的BDD:
更安全技术计划(STeP)
STeP是FDA 2020年推出的快速审评途径,旨在加速能够显著提高现有治疗方法安全性的器械的开发和上市,这些器械所涉及的疾病没有突破性器械计划所涵盖的那么严重,包括用于治疗或诊断非危及生命或可合理逆转的疾病或病症的器械。
STeP认定对象
同BDD对象,为器械或以器械为主的组合产品。
STeP认定标准及申请流程
STeP认定标准如下(同时满足):
同BDD申请时间相同,申请人可在提交器械上市申请前的任何时间申请STeP。STeP具体申请流程可参考BDD,其中,符合性评估和Q-Sub递交申请材料两个步骤应按照STeP认定标准和申请材料提交。STeP申请材料包括:器械描述、拟议适应证、预期的安全性改进、监管历史、STeP标准符合性研究资料、拟上市途径及其理由。
STeP标准符合性论证要点
STeP利好政策
纳入STeP之后,申请人除不能通过临床试验方案讨论方式获得器械开发的反馈意见外,其余均与BDD利好政策相同。
STeP获批数据情况
FDA既不公示纳入STeP的器械,也不公开纳入STeP后已上市的器械。
总结
BDD重点在于论证器械的临床有效性和满足重大医疗需求,STeP偏向于论证器械预期的安全性改进和减少风险,此外在认定对象、评定周期、申请提交时间、提交方式以及获得FDA加速指导流程上大体相似。但因为突破性器械是法定任务,如果出现项目配套资源不足的情况,FDA将优先BDD项目。
参考资料:
【供 稿】苏大检测医疗器械事业部法规中心



