近期,小编浏览EUDAMED网站,发现证书模块新增多条信息,在这里展开介绍。
Step 1:登录EUDAMED数据库网址:EUDAMED database - EUDAMED,点击证书模块。
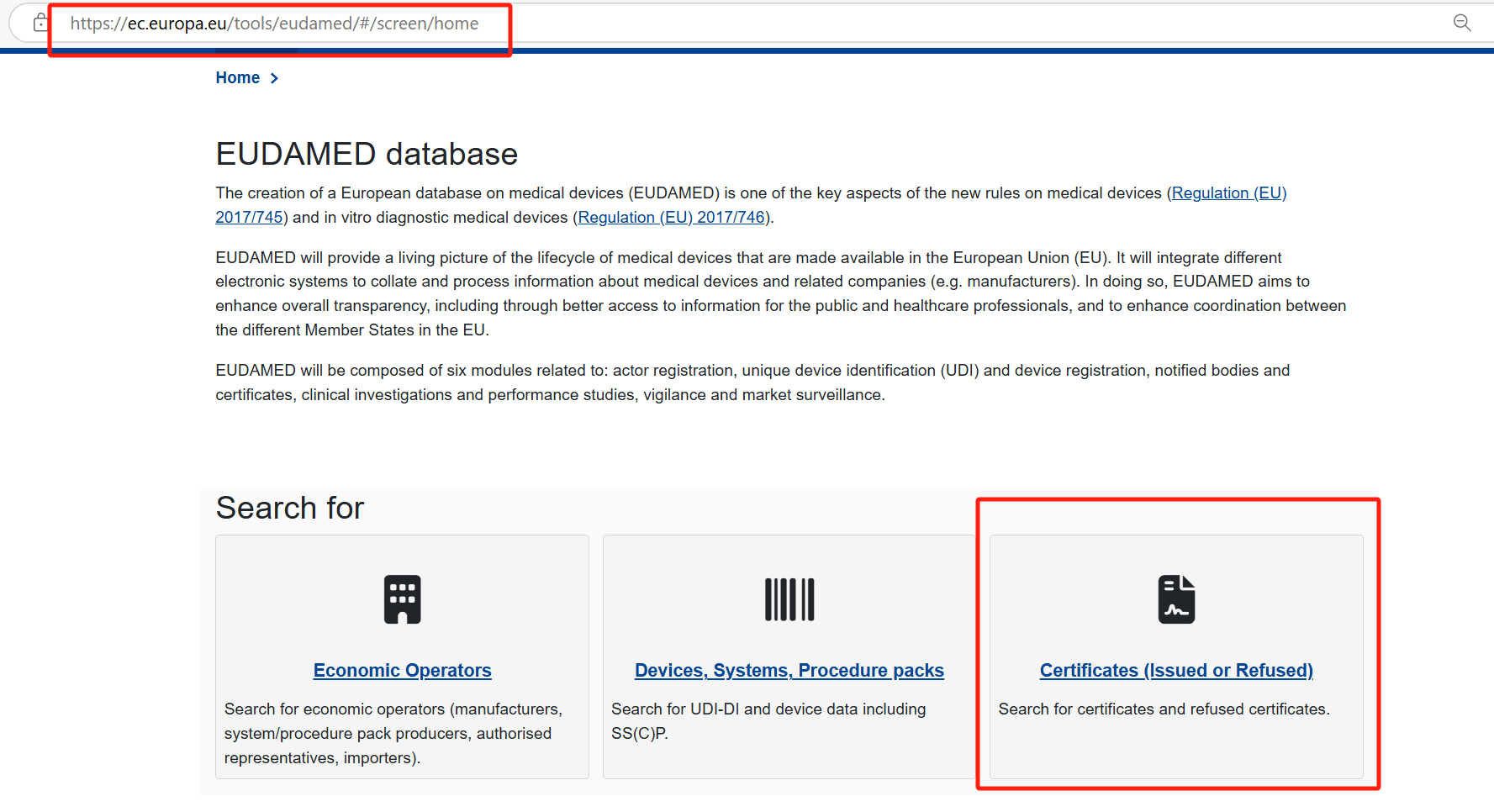 Step 2:根据情况,设置条件精确搜索证书。
Step 2:根据情况,设置条件精确搜索证书。
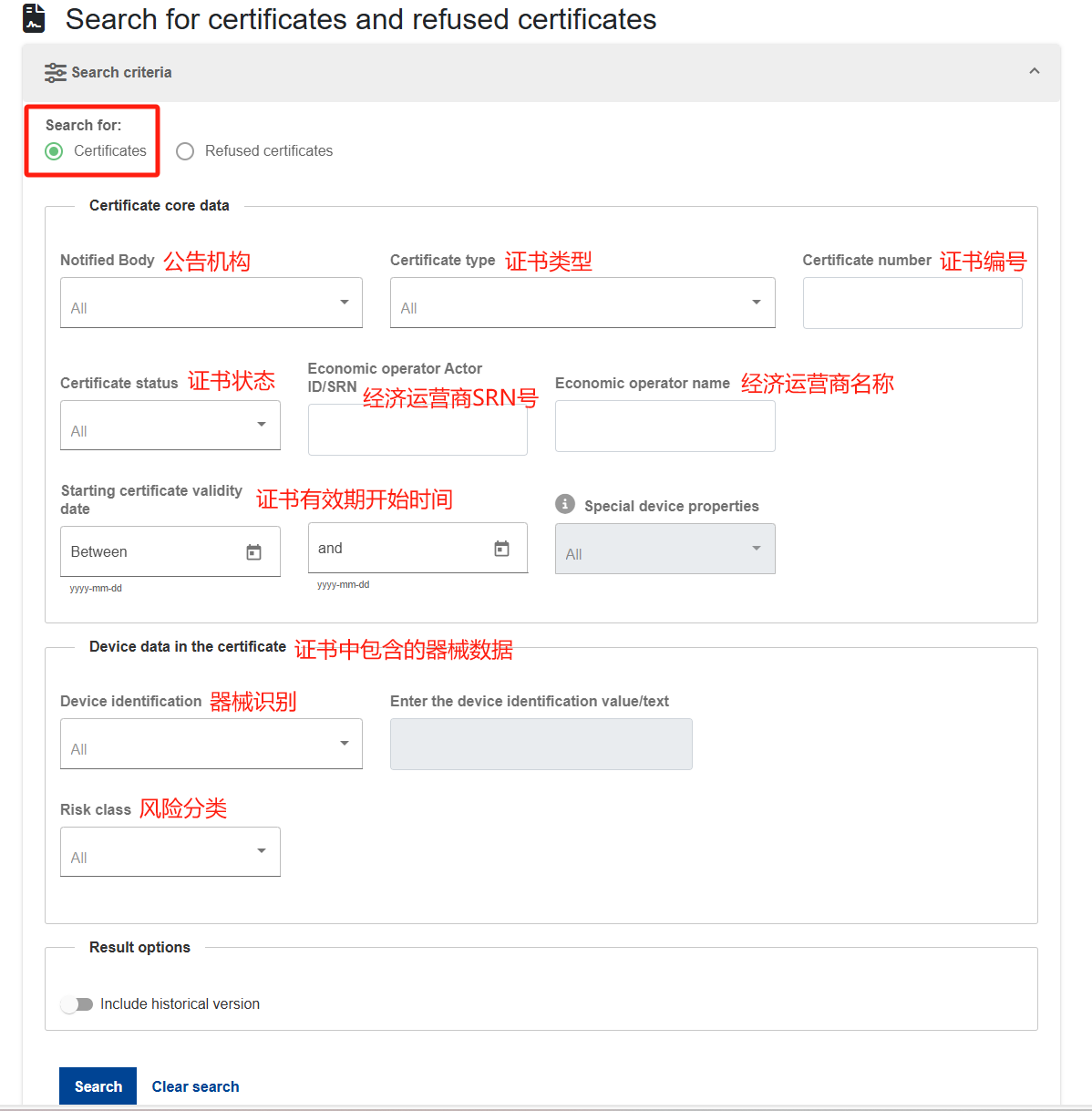 小编不设条件直接点击搜索,共找到881条记录。
小编不设条件直接点击搜索,共找到881条记录。
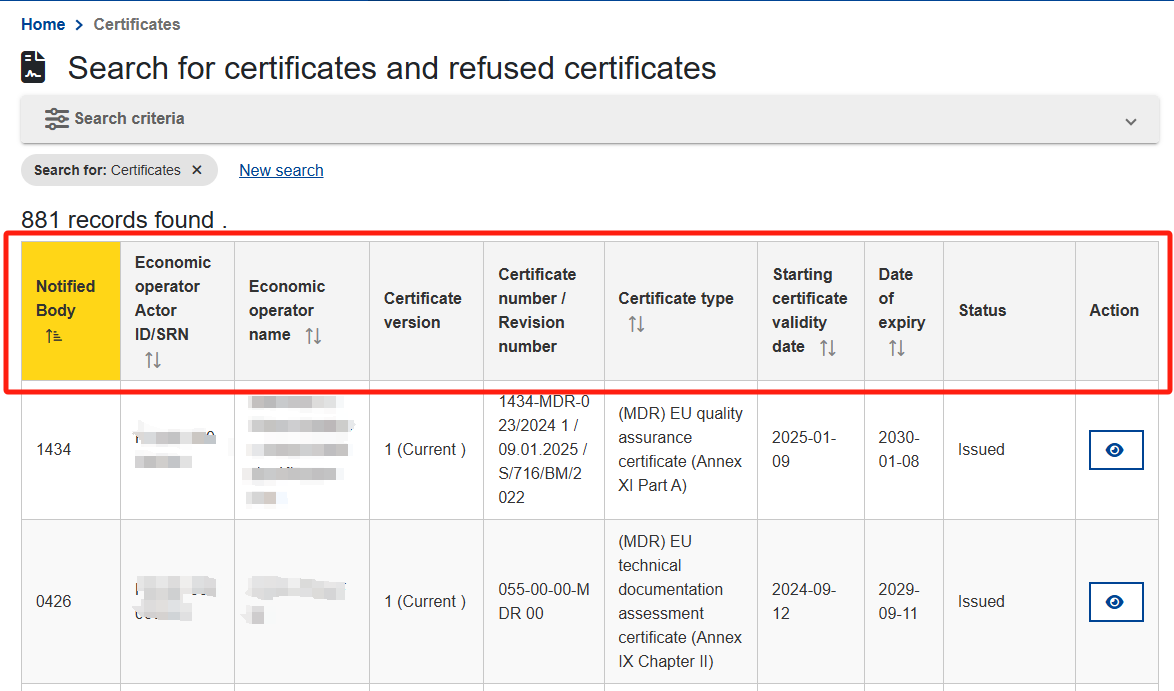 Step 3:若想进一步浏览证书,点击“Action”列下方框内的蓝眼睛。
Step 3:若想进一步浏览证书,点击“Action”列下方框内的蓝眼睛。
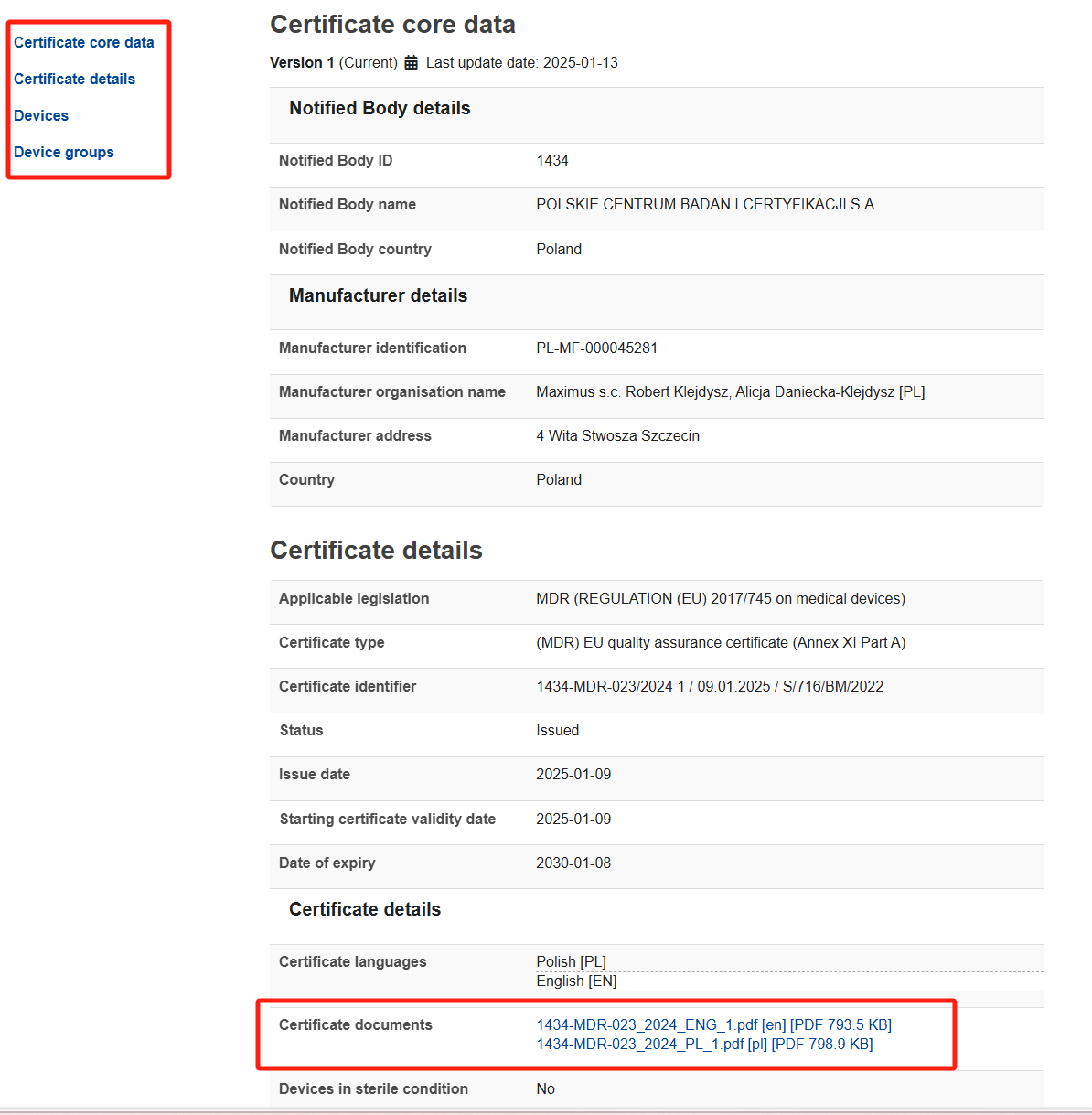
此页面介绍证书核心数据、证书详情、器械信息、器械组信息,其中在证书详情-证书文件处可查看证书。
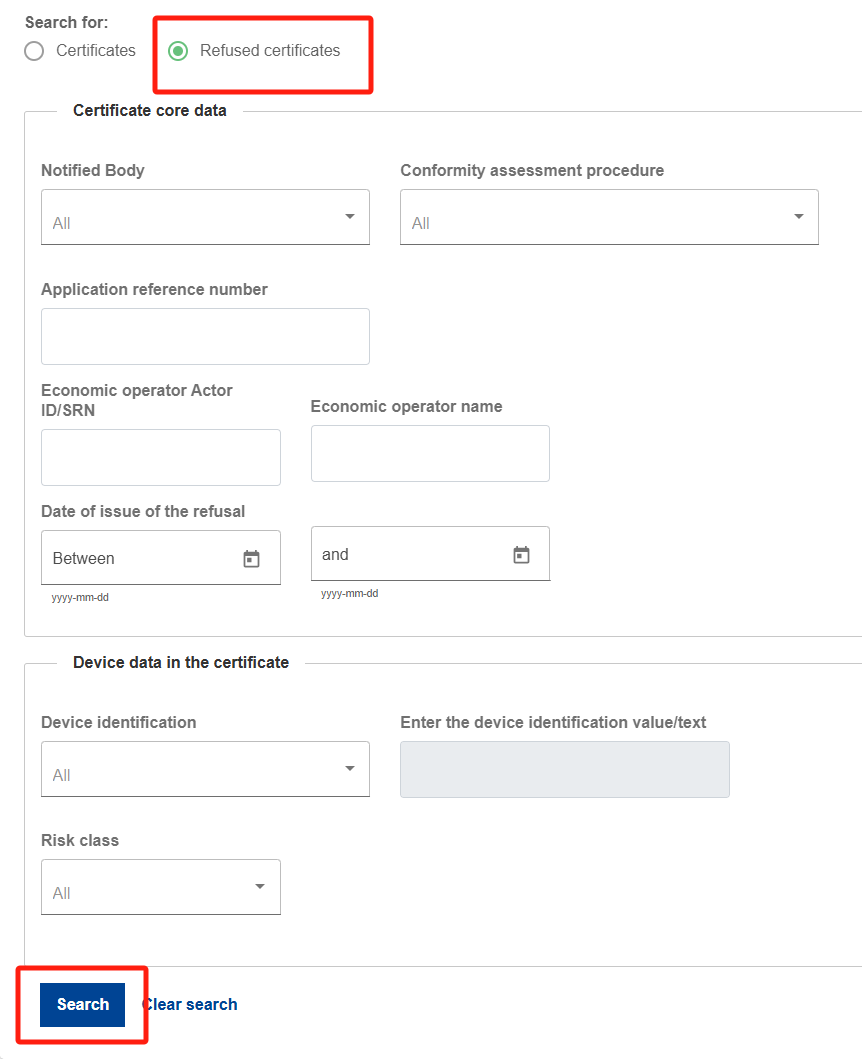
Step 4:返回至Step 1,点击被拒证书,搜索,可查询被拒证书信息。小编进行无条件搜索,发现目前有一条被拒记录。
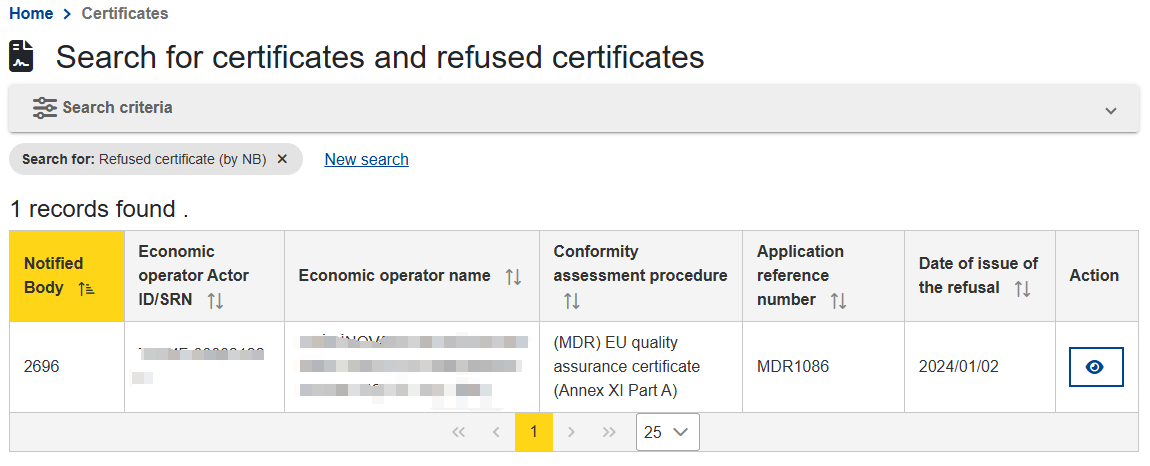
点击蓝色小眼睛,还可以看到被拒原因。
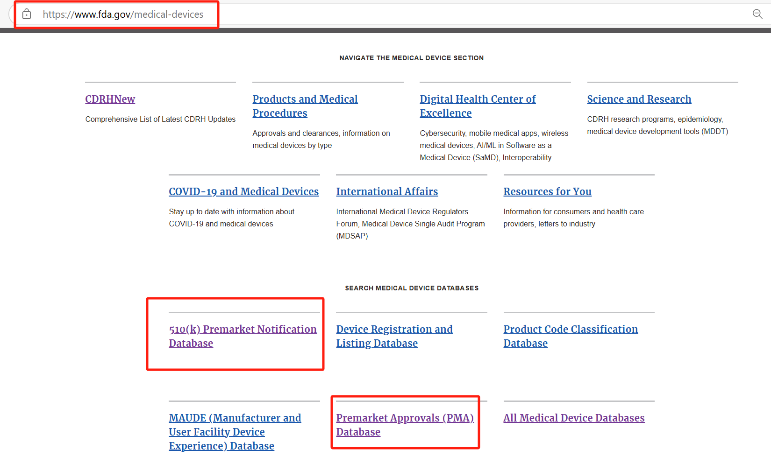
介绍完EUDAMED数据库的证书模块,让人不禁想到FDA的数据库,在这里小编介绍两个功能类似的数据库“510(k)Premarket Notification Database”和“Premarket Approvals(PMA)Database”。
Step 1:登录FDA医疗器械官网:Medical Devices | FDA,点击“510(k)Premarket Notification Database”或“Premarket Approvals(PMA)Database”模块,以下以510(k)数据库模块为例。
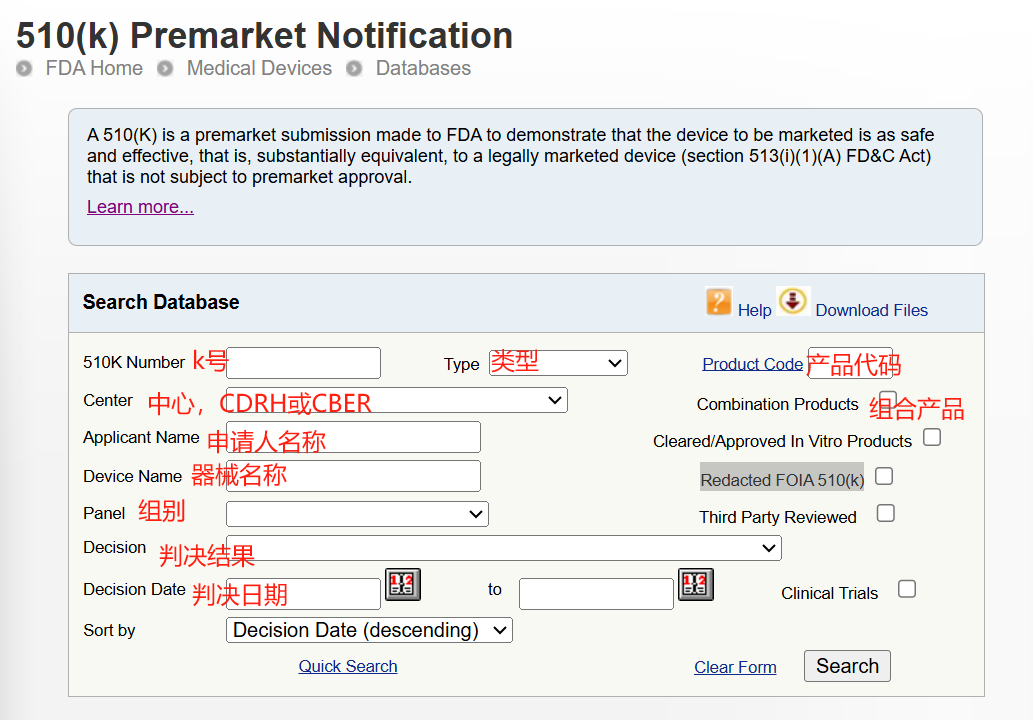
 Step 2:根据情况,设置条件精确搜索。
Step 2:根据情况,设置条件精确搜索。
 小编不设置条件直接点击搜索,单次最多显示500条记录,因此想要海量搜索的,需通过判决日期进行限制。
小编不设置条件直接点击搜索,单次最多显示500条记录,因此想要海量搜索的,需通过判决日期进行限制。
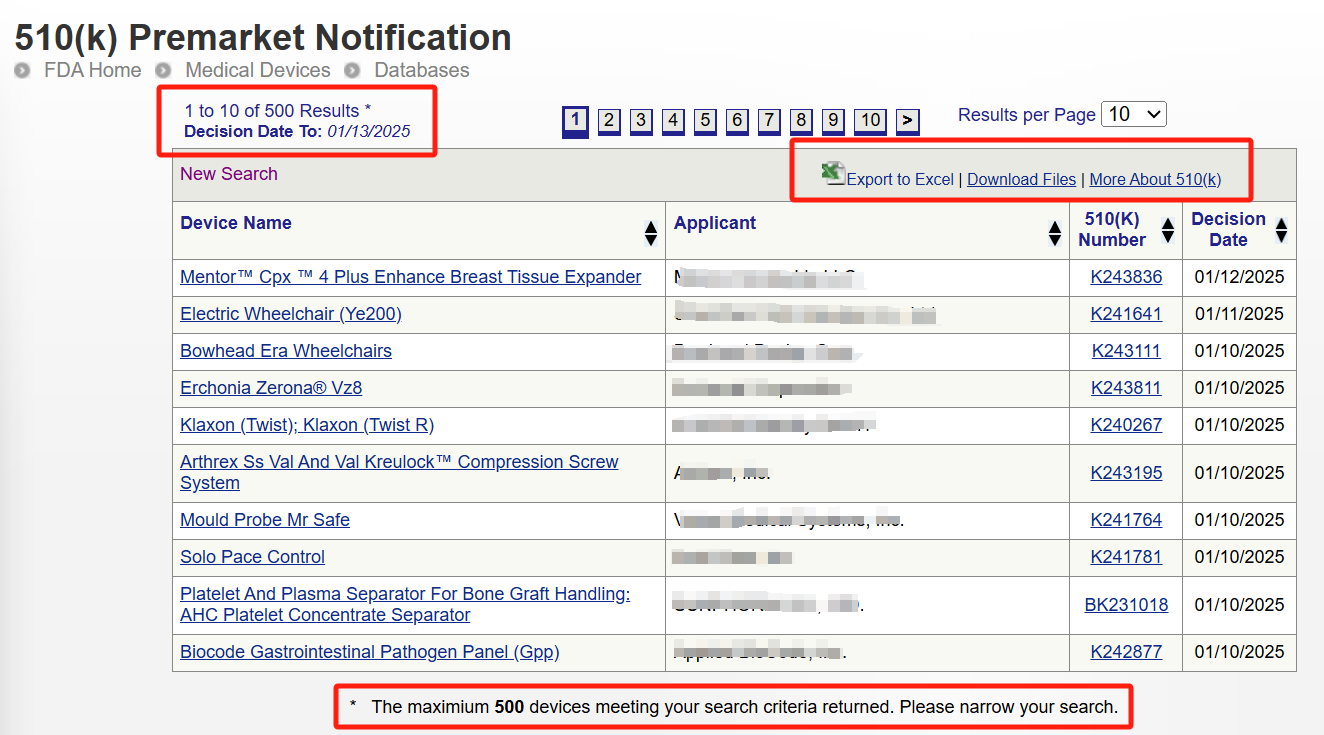 Step 3:点击具体K号,即可查询申报器械的详情。再点击Summary,即可看到申报器械信息及实质等同对比信息。
Step 3:点击具体K号,即可查询申报器械的详情。再点击Summary,即可看到申报器械信息及实质等同对比信息。
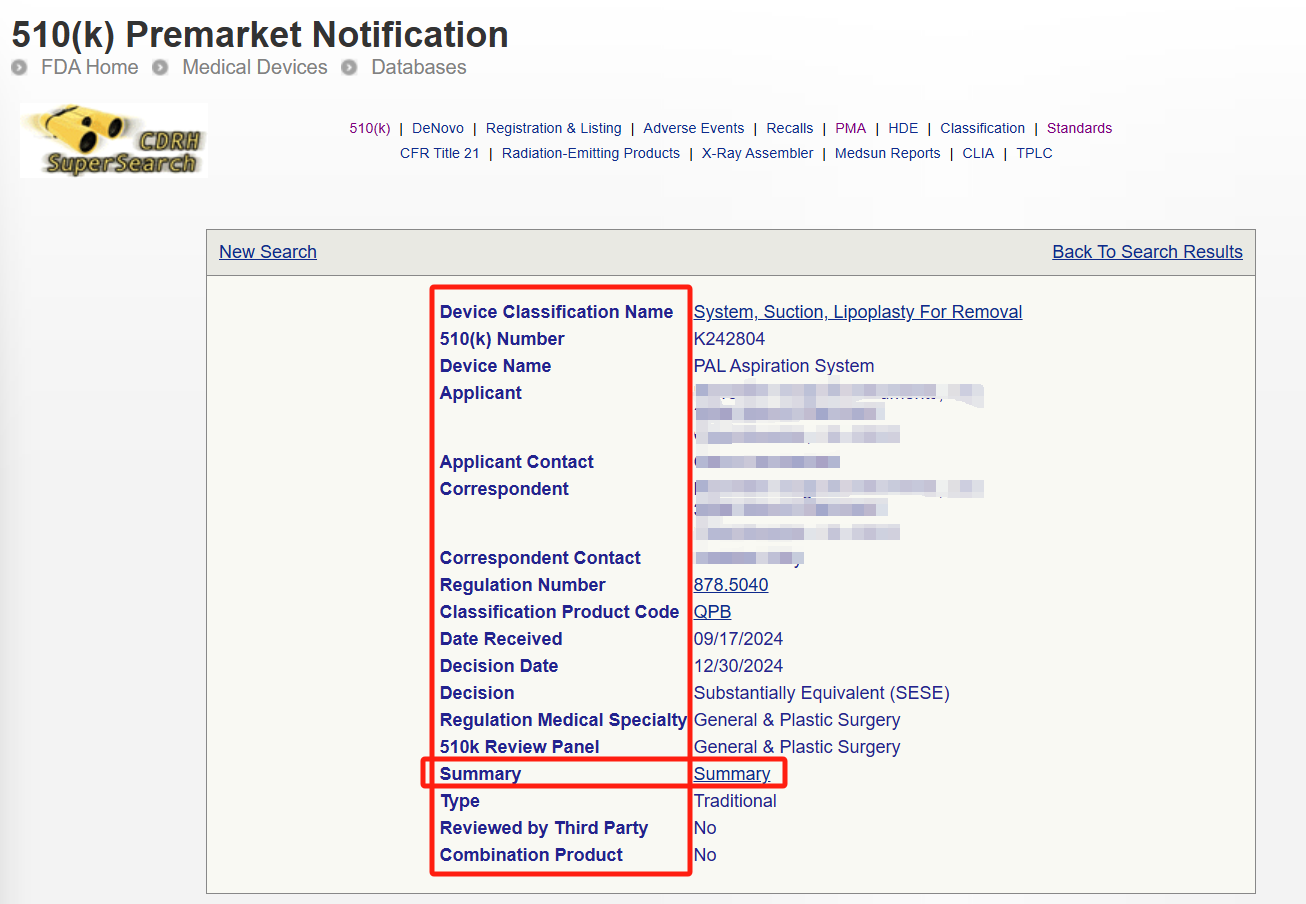 不论是MDR认证还是510(k)申报,都需要与合法已上市的同类产品进行比较。第一步就是寻找比对器械,这时候两大数据库的使用便显得尤为重要。各位读者赶紧去练练手吧。
不论是MDR认证还是510(k)申报,都需要与合法已上市的同类产品进行比较。第一步就是寻找比对器械,这时候两大数据库的使用便显得尤为重要。各位读者赶紧去练练手吧。
参考资料:



