公告
1.【NMPA】关于发布《血液净化体外循环系统 血液透析器、血液透析滤过器、血液滤过器及血液浓缩器用体外循环血路/液路》等10项医疗器械行业标准的公告(2025年第21号)- 2025.2.28
YY 0267—2025《血液净化体外循环系统 血液透析器、血液透析滤过器、血液滤过器及血液浓缩器用体外循环血路/液路》等10项医疗器械行业标准已经审定通过,现予以公布。标准编号、名称、适用范围和实施日期见附件。
特此公告。
原文链接:国家药监局关于发布《血液净化体外循环系统 血液透析器、血液透析滤过器、血液滤过器及血液浓缩器用体外循环血路/液路》等10项医疗器械行业标准的公告(2025年第21号)
2.【CMDE】关于2025年3月~4月医疗器械注册受理前技术问题咨询工作安排的通告(2025年第1号)- 2025.18
为做好医疗器械注册受理前技术问题咨询工作,指导行政相对人安排咨询时间,保证咨询工作质量,现就近期咨询工作安排通告如下:
一、轮值部门时间安排:
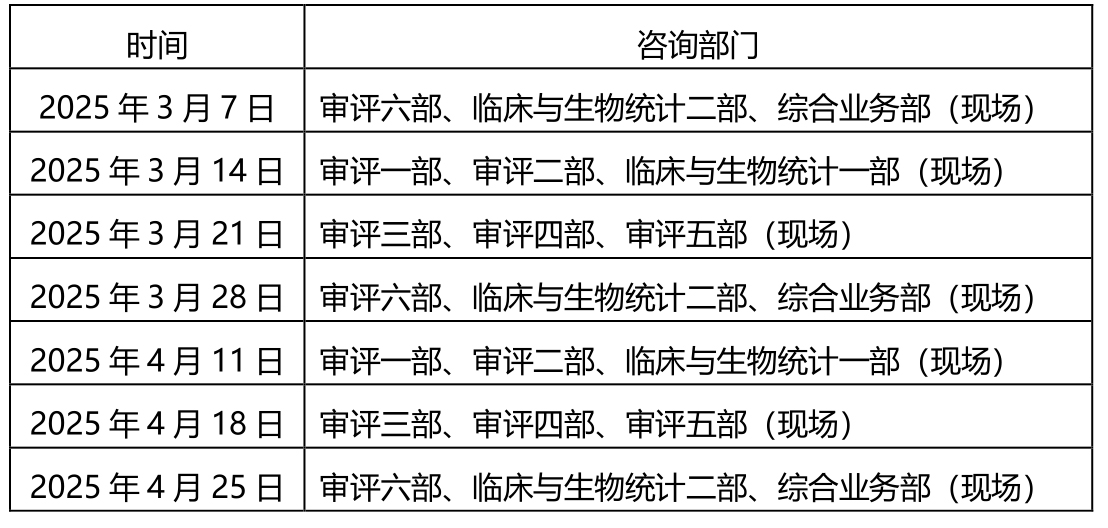 二、自2024年11月起,每个受理前技术问题咨询日各审评部、临床部、综合业务部可供预约的现场咨询号数量为20个,预约方式不变。按照中心2022年10月16日发布的《关于医疗器械受理前技术问题咨询工作安排调整的通告》(2022年第37号)的要求申请和办理。未预约现场咨询或预约未成功的单位,可选择邮件方式提交咨询申请。各受理前技术问题咨询参与单位咨询时间安排同器审中心,但不受轮值部门限制。
二、自2024年11月起,每个受理前技术问题咨询日各审评部、临床部、综合业务部可供预约的现场咨询号数量为20个,预约方式不变。按照中心2022年10月16日发布的《关于医疗器械受理前技术问题咨询工作安排调整的通告》(2022年第37号)的要求申请和办理。未预约现场咨询或预约未成功的单位,可选择邮件方式提交咨询申请。各受理前技术问题咨询参与单位咨询时间安排同器审中心,但不受轮值部门限制。
咨询时间:工作日每周五下午1:30至4:30(法定节假日除外),请申请人于下午3:00前取号。
咨询地点:北京经济技术开发区广德大街22号院一区2号楼一层。
原文链接:关于2025年3月~4月医疗器械注册受理前技术问题咨询工作安排的通告(2025年第1号)
3.【NMPA】关于批准注册376个医疗器械产品的公告(2025年1月)(2025年第16号) - 2025.2.12
2025年1月,国家药监局共批准注册医疗器械产品376个。其中,境内第三类医疗器械产品303个,进口第三类医疗器械产品36个,进口第二类医疗器械产品35个,港澳台医疗器械产品2个(具体产品见附件)。
特此公告。
原文链接:国家药监局关于批准注册376个医疗器械产品的公告(2025年1月)(2025年第16号)
征集
各有关单位:
为了规范产品技术审评,为注册申请人/监管人员提供关于应用纳米材料的医疗器械体外评价方法及计算机模拟方法的相关信息,我中心现已启动《应用纳米材料的医疗器械安全性和有效性评价指导原则 第五部分:体外评价方法》的制订工作。现征集制订工作参与单位,邀请具有相关工作经验的境内外生产企业、科研机构、临床机构等积极参与。
请有意向参与制订工作的单位填写参与单位信息征集表(附件),于2025年3月15日前统一以电子版形式报送我中心。
联系人:陈宽、杨宇希
联系电话:010-86452843、010-86452833
电子邮箱:chenkuan@cmde.org.cn、yangyx@cmde.org.cn
原文链接:关于征集参与《应用纳米材料的医疗器械安全性和有效性评价指导原则 第五部分:体外评价方法》制订工作的相关企业及单位信息的通知



