5月20日,欧盟委员会发布了MDR法规下UDI系统使用的常见问题解答。本期小编先带您了解欧盟MDR法规下的UDI,下期将梳理和总结欧盟委员会发布的UDI常见问题及解答。
一、什么是UDI,如何生成UDI码?
器械唯一标识(unique device identification, UDI)是通过全球公认的设备标识和编码标准创建的一系列数字或字母代码。在欧盟市场上,UDI适用于除定制器械外的所有医疗器械和体外诊断器械。
UDI的使用有如下意义:

UDI由固定器械识别码(DI,device identifier)和可变生产识别码(PI,production identifier)组成。UDI-DI是特定于某一制造商和器械的UDI器械标识符,提供EUDAMED数据库中MDR法规附件VI第B部分所述信息访问途径;UDI-PI用于标识所生产的器械单元,以及MDR法规附录VI第C部分中包装后的器械(若适用)。
UDI 必须提供人工可读(纯文本)和机器可读两种格式,后者使用自动识别与数据采集(AIDC)技术。
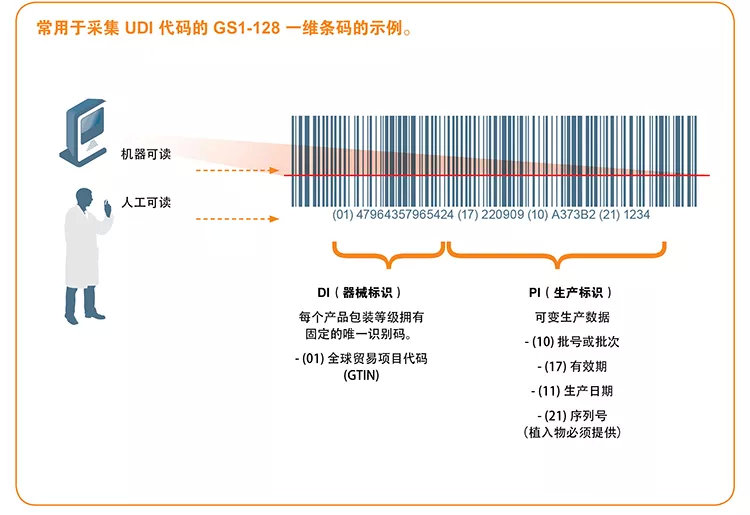
UDI码的生成流程大致为:

二、什么是Basic UDI-DI,如何生成Basic UDI-DI?
Basic UDI-DI是访问Eudamed数据库中器械相关信息时的关键词,也是CE证书、符合性声明、技术文档、安全和临床性能摘要等相关文档中的关键信息。Basic UDI-DI用于识别器械组,即具有相同预期用途、风险等级、基本设计和制造特征的器械。它独立于器械的包装/标签,不会出现在任何贸易商品上。
Basic UDI-DI由Company Prefix、Model Reference、校验码组成。其中,Company Prefix为厂商识别代码,与UDI中的一致;Model Reference,为产品识别代码,由企业自行编制,可以是字母+数字的形式;校验码须经由发行实体生成。
三、Basic UDI-DI与UDI-DI有何区别?
四、制造商对UDI应负什么责任?
除定制医疗器械、性能研究/实验用器械除外,根据MDR法规,任何制造商在将器械投放市场前均应满足如下UDI要求:
五、UDI发行实体
2018年底启动申请征集后,欧盟委员会指定了以下四个UDI发行实体:
参考资料
Regulation(EU)2017/745
https://ec.europa.eu/health/medical-devices-topics-interest/unique-device-identifier-udi_en