当地时间2025年5月21日,欧盟委员会在德国的斯图加特市举办了EUDAMED专题研讨会。会议共有5个议程,如下:
 对于EUDAMED的六大模块,想必大家早已耳熟能详。今天着重介绍EUDAMED逐步推出的实施时间表和计划(草稿版)。
对于EUDAMED的六大模块,想必大家早已耳熟能详。今天着重介绍EUDAMED逐步推出的实施时间表和计划(草稿版)。
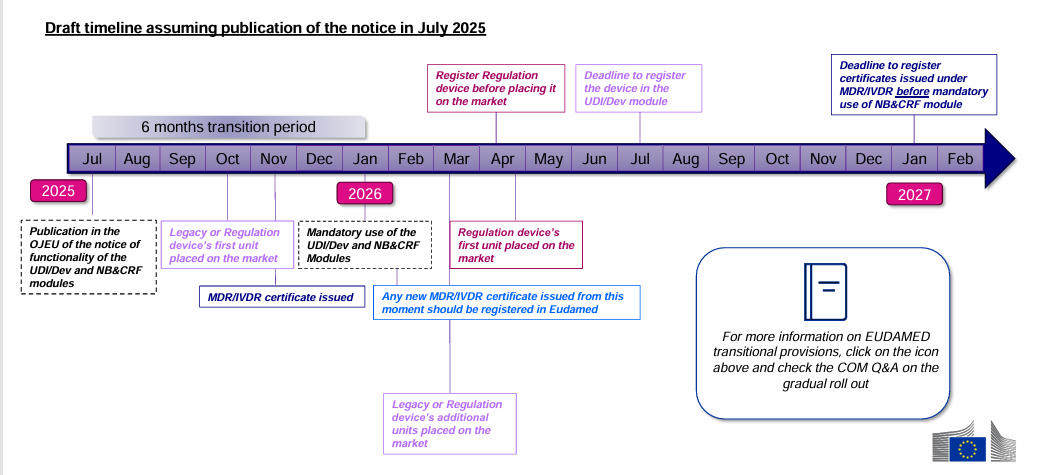
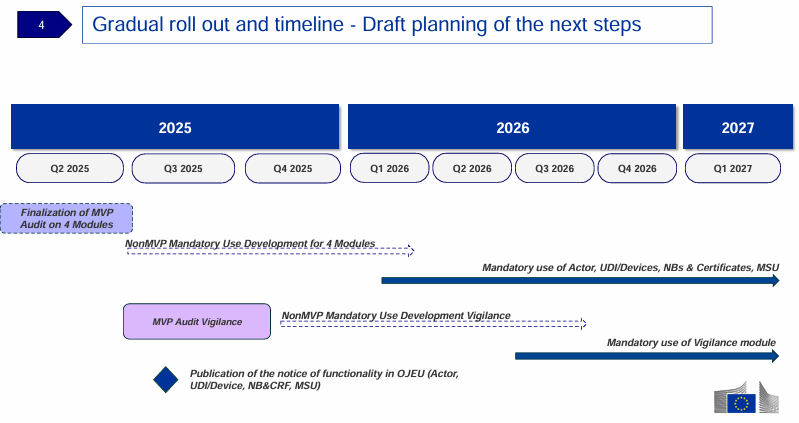
关键时间节点:
2025年7月:在欧盟官方公报OJEU上发布UDI/Devices、NB&CRF、Market Surveillance模块运行的通知;
2026年1月:强制使用UDI/Devices、NB&CRF、Market Surveillance模块;任何新签发的MDR/IVDR证书从此时起都应在EUDAMED系统上进行登记;
2026年7月:Vigilance模块强制使用。
2026年7月:在EUDAMED UDI/Devices模块注册器械信息的最后期限。
EUDAMED数据库的使用将大大提高医疗器械产品在欧盟成员国内的透明度,但对于制造商而言需要更多的精力、成本进行合规。因此制造商应提前布局,根据EUDAMED实施的时间表提前完成各模块的对接。
参考资料:EUDAMED Workshop – 21 May 2025 - Stuttgart, Germany - European Commission



