公告
1、【NMPA】关于发布YY 0300—2025《牙科学 修复用人工牙》等38项医疗器械行业标准的公告(2025年第59号)- 2025.6.25
YY 0300—2025《牙科学 修复用人工牙》等38项医疗器械行业标准已经审定通过,现予以公布。标准编号、名称、适用范围和实施日期见附件。
特此公告。
原文链接:国家药监局关于发布YY 0300—2025《牙科学 修复用人工牙》等38项医疗器械行业标准的公告(2025年第59号)
2、【NMPA】更新医疗器械标准目录 - 2025.6.24
截至2025年6月底,现行有效医疗器械标准共2039项,其中国家标准304项(强制性标准88项,推荐性标准216项),行业标准1735项(强制性标准177项,推荐性标准1558项)。
为方便标准的查询使用,更好地发挥标准的技术支撑作用,将上述2039项标准的适用范围以及标准层级、效力、名称、归口单位等信息,按照通用技术领域和专业技术领域进行编排,通用技术领域细分为医疗器械质量管理、医疗器械唯一标识、医疗器械包装、医疗器械生物学评价、医用电气设备通用要求、消毒灭菌通用技术、医疗器械临床评价及其他8个部分,专业技术领域细分为外科手术器械、医用防护器械、医用X射线设备及用具、医学实验室与体外诊断器械和试剂等33个部分。标准编排的基本原则是:先国家标准后行业标准;同级标准按标准编号先后顺序;专业技术领域标准先通用标准、后产品标准、方法标准,系列或相近标准并排。部分系列标准因专业领域不同、已整合或修订的原因,系列标准号可能不完全连贯,详情请点击原文链接。
原文链接:医疗器械标准目录
3、【NMPA】关于批准注册236个医疗器械产品的公告(2025年5月)(2025年第58号) - 2025.6.19
2025年5月,国家药监局共批准注册医疗器械产品236个。其中,境内第三类医疗器械产品189个,进口第三类医疗器械产品22个,进口第二类医疗器械产品23个,港澳台医疗器械产品2个(具体产品见附件)。
特此公告。
原文链接:国家药监局关于批准注册236个医疗器械产品的公告(2025年5月)(2025年第58号)
4、【CMDE】关于2025年7月~8月医疗器械注册受理前技术问题咨询工作安排的通告(2025年第11号)- 2025.6.19
为做好医疗器械注册受理前技术问题咨询工作,指导行政相对人安排咨询时间,保证咨询工作质量,现就近期咨询工作安排通告如下:
一、轮值部门时间安排:
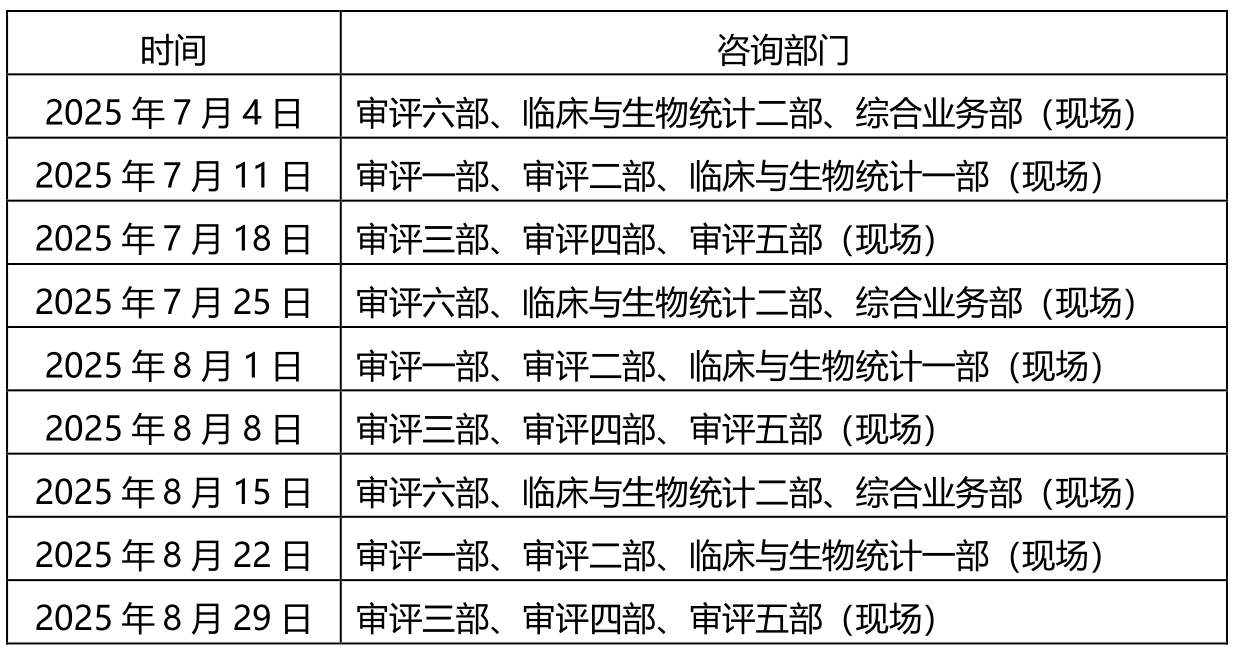 二、自2024年11月起,每个受理前技术问题咨询日各审评部、临床部、综合业务部可供预约的现场咨询号数量为20个,预约方式不变。按照中心2022年10月16日发布的《关于医疗器械受理前技术问题咨询工作安排调整的通告》(2022年第37号)的要求申请和办理。未预约现场咨询或预约未成功的单位,可选择邮件方式提交咨询申请。各受理前技术问题咨询参与单位咨询时间安排同器审中心,但不受轮值部门限制。
二、自2024年11月起,每个受理前技术问题咨询日各审评部、临床部、综合业务部可供预约的现场咨询号数量为20个,预约方式不变。按照中心2022年10月16日发布的《关于医疗器械受理前技术问题咨询工作安排调整的通告》(2022年第37号)的要求申请和办理。未预约现场咨询或预约未成功的单位,可选择邮件方式提交咨询申请。各受理前技术问题咨询参与单位咨询时间安排同器审中心,但不受轮值部门限制。
咨询时间:工作日每周五下午1:30至4:30(法定节假日除外),请申请人于下午3:00前取号。
咨询地点:北京经济技术开发区广德大街22号院一区2号楼一层。
原文链接:关于2025年7月~8月医疗器械注册受理前技术问题咨询工作安排的通告(2025年第11号)
5、【NMPA】关于对药品医疗器械质量安全内部举报人举报实施奖励的公告(2025年第41号)-2026.5
为进一步发挥药品医疗器械产业链质量安全内部监督作用,及时发现和控制药品医疗器械安全风险,根据《中华人民共和国药品管理法》《中华人民共和国疫苗管理法》《医疗器械监督管理条例》《市场监管领域重大违法行为举报奖励暂行办法》(国市监稽规〔2021〕4号,以下简称《办法》)等规定,现就药品医疗器械质量安全内部举报人举报奖励有关事项进行公告,详情请点击原文链接。
原文链接:国家药监局 财政部 市场监管总局 关于对药品医疗器械质量安全内部举报人举报实施奖励的公告(2025年第41号)



