凡是与人体循环血有直接或间接接触的医疗器械,如果没有足够的数据证明其满足血液相容性要求,都要开展血液相容性评价与试验。医疗器械与血液有间接或直接接触的,将与血液中血小板、红细胞、白细胞及血液中血浆蛋白等其他成分发生作用,导致血栓形成、溶血、血浆蛋白粘附等,从而对人体产生有害的影响。
血液相容性评价与试验主要用来评估与血液接触的医疗器械、或用于血液或血液制品材料对于人体的影响。在设计评价与试验方案时,需要将产品设计、临床使用、使用环境和风险收益等因素纳入考虑。
按照国家标准GB/T16886.4-2003,血液相容性评价与试验根据被测体系与血液相互作用可分为五类:血栓形成、凝血、血小板和血小板功能、血液学、补体系统。
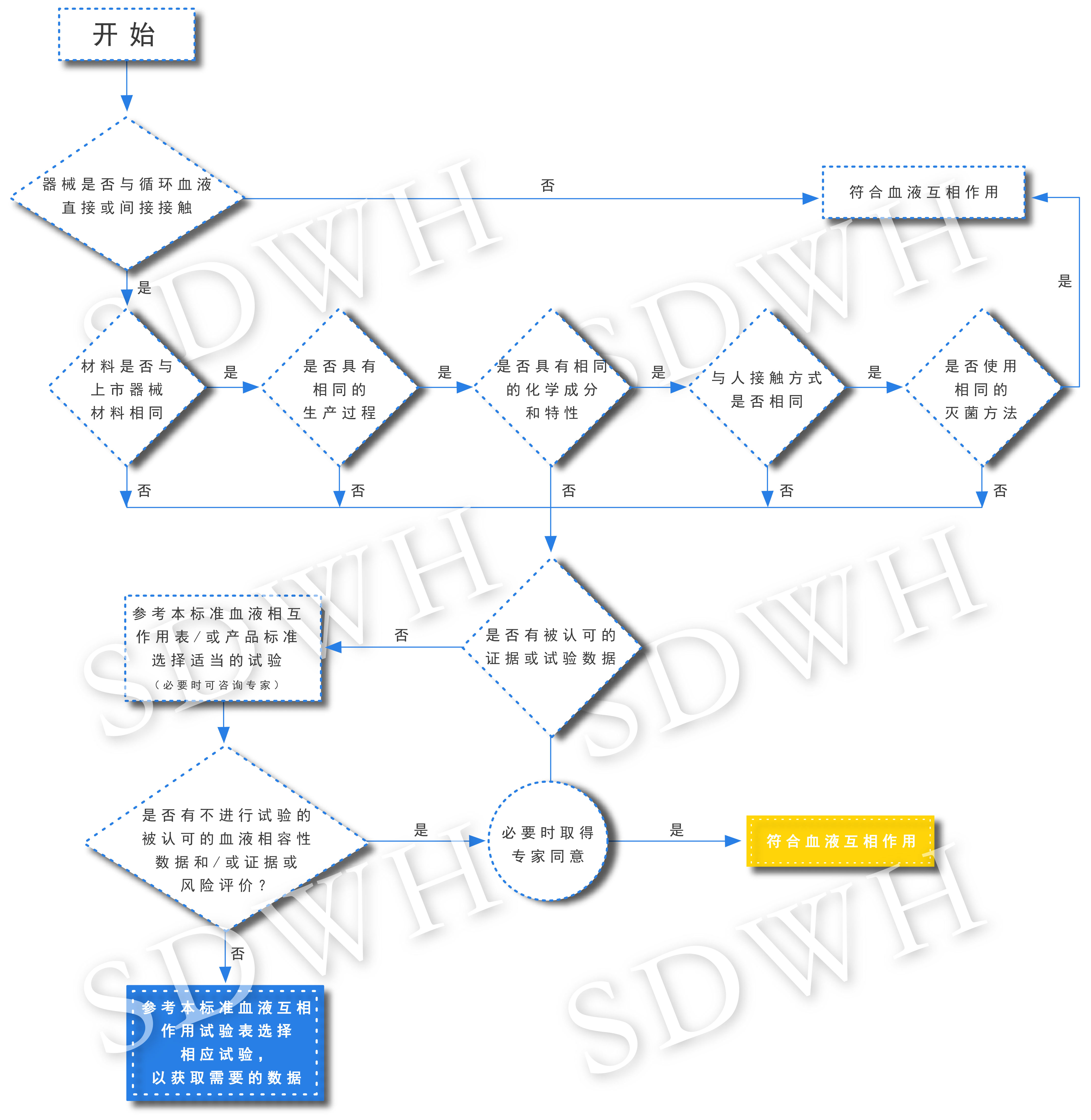
国家标准:GB/T16886.4-2003《医疗器械生物学评价第4部分:与血液相互作用试验选择》(点击查看原文)
国际标准:ISO 10993.4-2017《Biological evaluation of medical devices-Part 4:-Selection of tests for in teractions with blood》(点击查看原文)
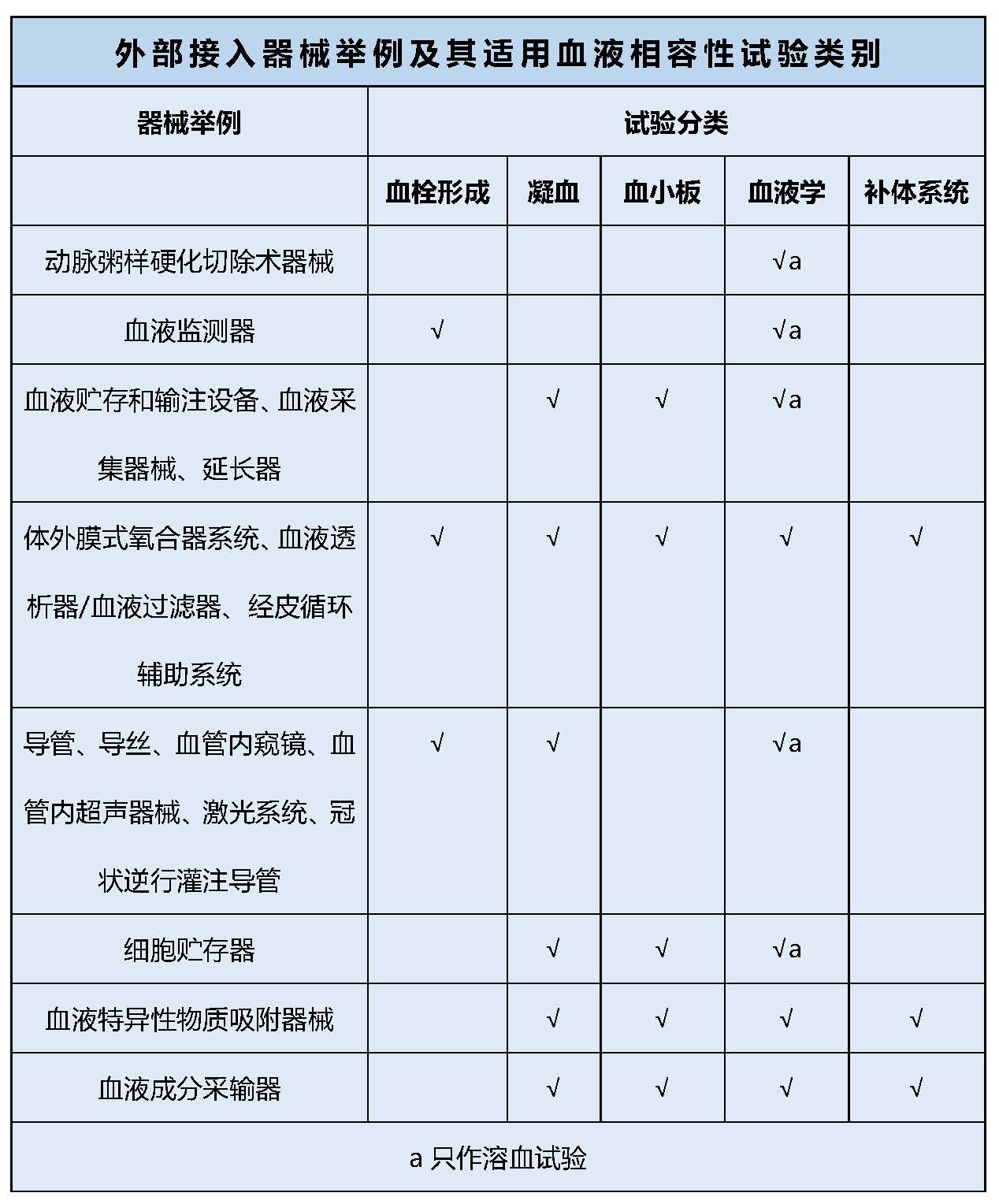
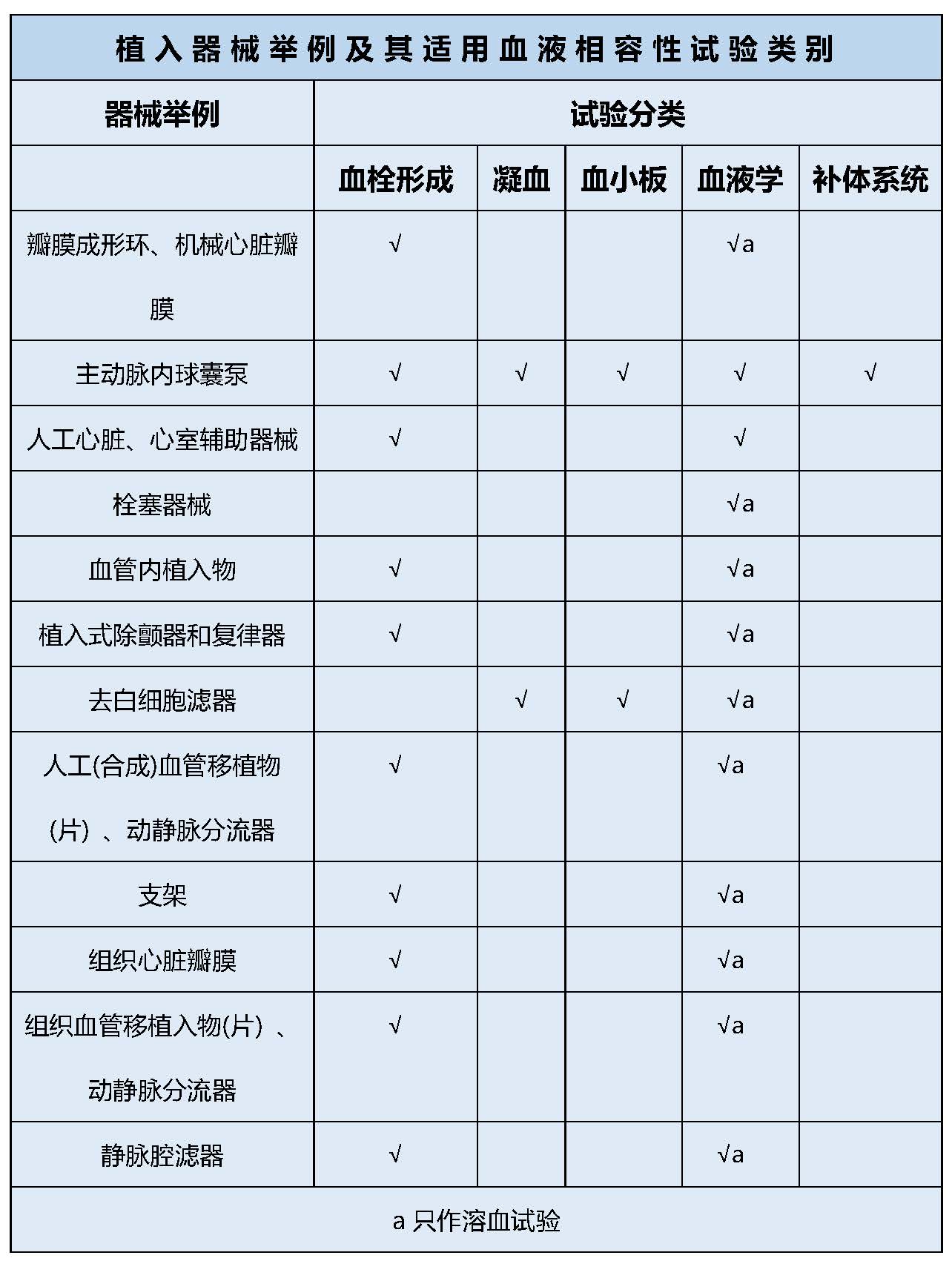
医疗器械产品按照与循环血液接触分为外部接入器械和植入器械。标准GB/T16886.4-2003中给出了这两类器械的产品举例及使用的试验类别。小编已为您搬过来啦!
苏州大学卫生与环境技术研究所是从业30余年的第三方医疗器械检验检测机构,提供专业的生物相容性检测,其中包括化学/物理表征、细胞毒性试验、刺激和致敏试验、热源/内毒素试验、遗传毒性、植入试验、血液相容性评价与试验、全身毒性试验(急性、亚急性、亚慢性、慢性)、致癌性试验、体内/体外降解试验。我所具有丰富的医疗器械产品血液相容性评价与试验项目经验,截止本月中旬,我所已完成1700+项血液相容性样品检测项目,助力600+企业产品实现上市销售。以下是我所血液相容性评价与试验的代表性项目经验,供您参考:
血栓形成
中心静脉导管、造影导管、聚甲基戊烯中空纤维氧合膜丝、超硬导丝、造影导丝、PTA球囊扩张导管、导引导管、房间隔穿刺鞘、磁定位高密度标测导管、一次性使用固定弯标测导管、PTCA球囊导管、一次性使用超滑导管鞘、外周血管支架。
凝血
血液透析器、中心静脉导管、外周血管支架、介入人工生物心脏瓣膜、集成式膜式氧合器、亲水涂层导丝、抗凝涂层管道、血液透析器、一次性使用安全采血针、医用水凝胶涂层、无涂层管道、PTCA球囊导管、延长管、贮血器组装品、镍钛合金支架系统。
血小板
血液透析器、中心静脉导管、外周血管支架、介入人工生物心脏瓣膜、集成式膜式氧合器、导管鞘套装、抽吸延长管、延长管、贮血器组装品、导管鞘套装、一次性使用血细胞分离器、三通旋塞、压力延长管、聚醚砜中空纤维膜、静脉留置针、穿刺针、心内导引鞘主体、导管鞘扩张器、一次性使用滴定管式输液器、可吸收止血纱。
血液学
血液透析器、血液过滤器、亲水涂层导丝、抗凝涂层管道、压力传感器、一次性使用静脉留置针、一次性使用静脉留置针延长管座、介入人工生物心脏瓣膜经心尖植入器、双级静脉插管、深部组织大出血推注式急救止血剂、足跟采血器、可调控型导引鞘组、可吸收止血微球、非吸收性外科缝线、一次性使用活体取样钳、医用X光跟踪线、一次性使用输血器、带线缝合针(医用涤纶编织线)。
补体系统
血液透析器、有创压力监测传感器套装、中心静脉导管、覆膜支架、介入人工生物心脏瓣膜、集成式膜式氧合器套包、一次性透析用血液回路管、人类免疫缺陷病毒(HIV)吸附过滤器、聚醚砜中空纤维膜、富血小板真空采血管、净化处理后的吸附剂。
【文章参考】 GB/T16886.4-2003、ISO 10993-4:2017、《医疗器械监督管理条例》
【全文整理】苏州大学卫生与环境技术研究所
【声明】如果您认为我们的内容或来源标注与原文不符,请告知我们,我们将与您积极协商解决。谢谢大家的关注!