国家药品监督管理局医疗器械技术审评中心于2020年06月24日发布通知:关于公开征求《医疗器械未知可沥滤物评价方法建立及表征技术审查指导原则(征求意见稿)》意见。旨在帮助和指导申请者对医疗器械产品注册申报资料进行准备,以满足技术审评的基本要求。同时有助于审评机构对产品进行科学规范的审评,提高审评工作的质量和效率。
医疗器械可沥滤物是指医疗器械或材料在临床使用过程中释放出的物质的统称。作为医疗器械生物学评价的一部分,可沥滤物对人体安全性的潜在风险应结合毒理学风险进行评估。根据可沥滤物研究体系不同,分为根据相关信息识别的已知可沥滤物和根据未知可沥滤物研究体系鉴别的未知可沥滤物。本指导原则即提供了未知可沥滤物研究体系。
适用于医疗器械注册申报或产品开发等环节时,针对不同评价目的,在进行未知可沥滤物研究时,对医疗器械未知可沥滤物评价方法建立和表征提供参考。
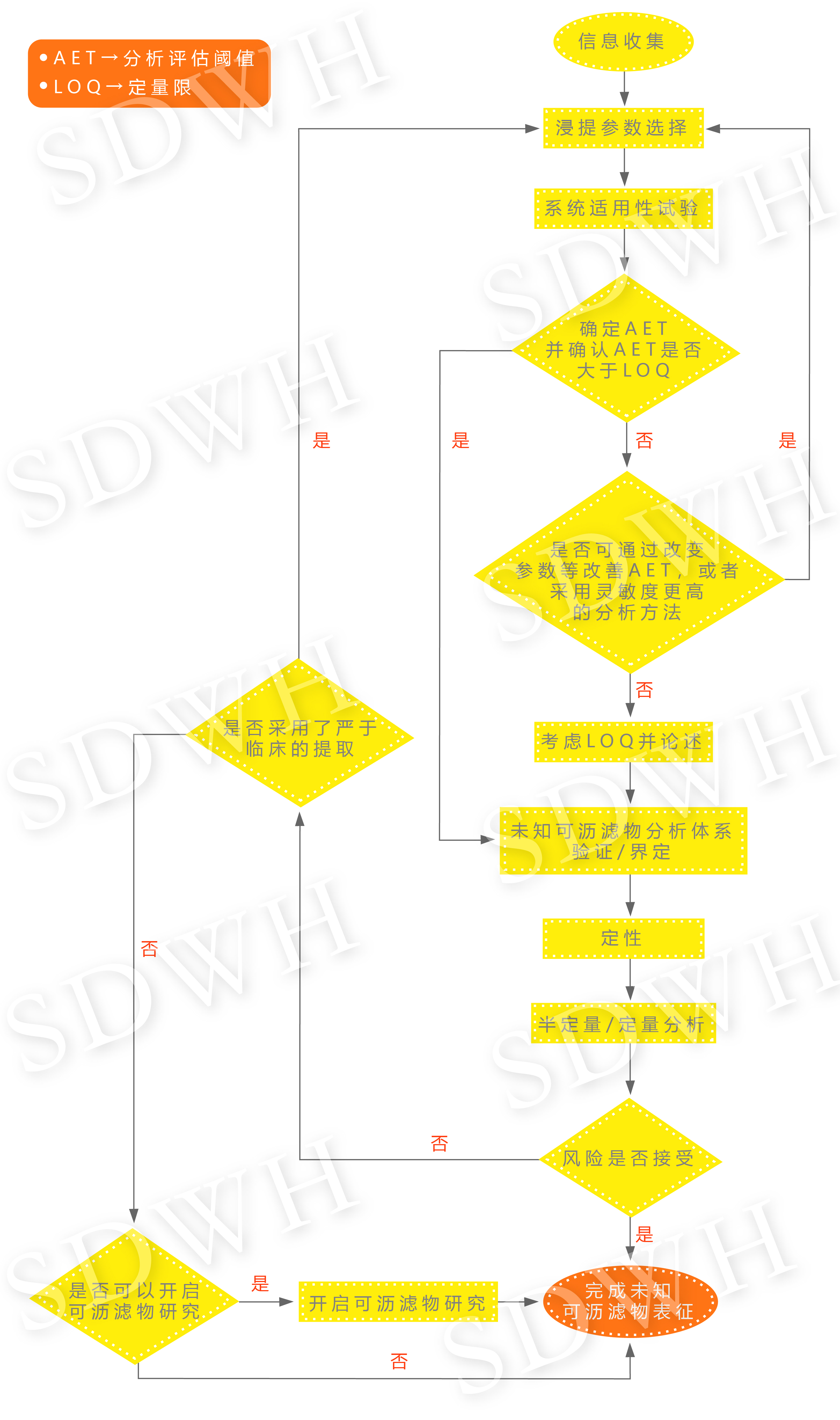
医疗器械产品中未知可浸提物和可沥滤物通常采用色谱-质谱联用进行定性定量分析。对未知可沥滤物解析需要通过对已有知识的检索来实现,也就是依赖数据库。建立和评价一个数据库的可以从以下四方面考虑:
考虑到数据库的主要目的是分析未知的可浸提物/可沥滤物,所以简单来看,数据库中所收录的化合物越多,遗漏就越少。
对于数据库中每一个化合物的结构和名称、所用的分析方法及该化合物对应的特征性响应参数(如色谱的保留时间)、谱图是最基本的信息。另一方面是数据库中包含的分析方法种类的多样性。
利用数据库来研究未知可沥滤物的前提是数据库的信息要准确并严谨可信,而“准确“主要体现在化合物鉴别上。在建立数据库的时候通常需要“三重印证”或至少“两重互补印证”。
未知可沥滤物研究,未知可沥滤物的遗漏是潜在风险的最主要来源。因而,数据库的基本结构和框架搭建起来后,可以考虑进一步对数据库进行内部归类和结构调整,在实践中对其进行优化和完善。
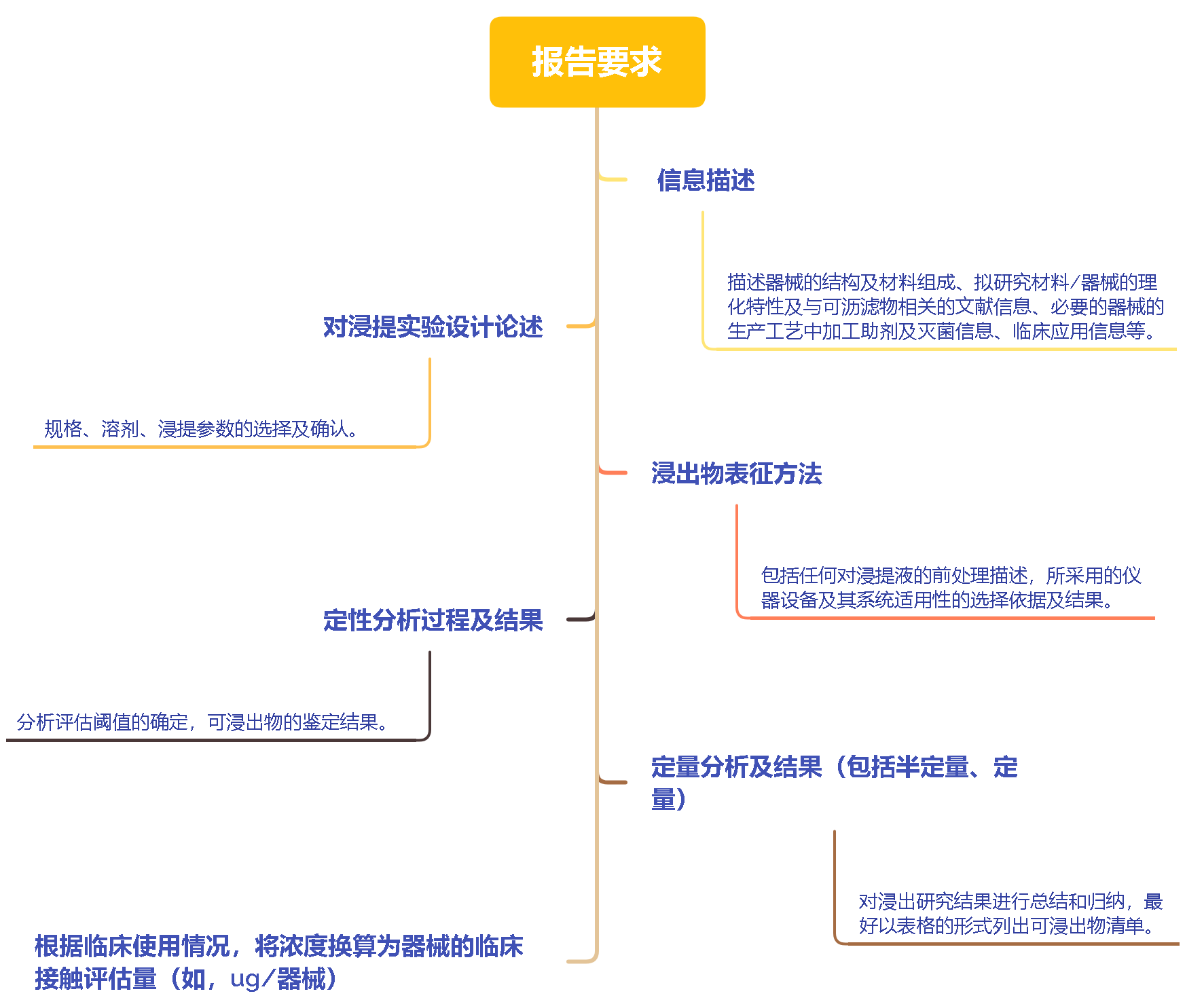
报告要求
点击查看原文:https://www.cmde.org.cn/CL0004/21163.html
【原文来源】国家药品监督管理局医疗器械技术审评中心
【全文整理】苏州大学卫生与环境技术研究所
【声明】如果您认为我们的内容或来源标注与原文不符,请告知我们,我们将与您积极协商解决。谢谢大家的关注!



