上期小编已为大家带来《【医械检测科普系列之4】探析植入后局部反应试验》,反响热烈(感兴趣或者需要复习的小伙伴可以戳上面链接哦)。本期推出的是16886中第7部分环氧乙烷灭菌残留量相关内容,包括涉及的相关标准、环氧乙烷灭菌残留量限量和残留量测定等。
《科普系列》专题是小编根据16886系列标准精心打磨,用心锤炼而来,旨在帮助大家更全面准确地理解标准的内容。感谢大家多多支持哦!动动您的小手指,点赞、收藏+关注哟!
环氧乙烷(EO)是一种广泛使用的化学灭菌剂,EO灭菌是当前医疗器械灭菌最主要的两种方式之一。气态EO灭菌是化学灭菌法的一种,由于其对细菌、病毒、芽胞等绝大多数微生物均具有强大的灭菌作用,灭菌范围极广。加之EO具有穿透性强、灭菌温度低、对产品基本无损(相对于辐照灭菌)等特点,成为目前医疗器械尤其是一次性使用医械的两大主流灭菌方法之一,在国内外均有广泛使用 。
由于灭菌过程是一个特殊过程,过程确认是无菌保证的重要环节。EO灭菌确认有半周期法、部分阴性法等不同方法,各方法侧重点不同,但均会涉及到微生物挑战器械、EO残留、产品族分类等基本问题。在确定EO对医疗器械灭菌的适宜性时,重要的是在产品正常使用中EO、2-氯乙醇(ECH)和乙二醇(EG)残留水平对患者产生的最小风险。因此,EO灭菌残留量显得十分重要。
那么EO灭菌残留量到底讲了什么呢?小编已为您梳理出重点内容:
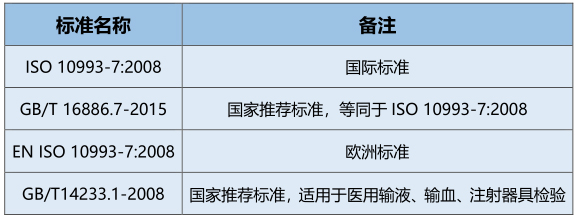
一、EO灭菌残留量涉及的相关标准
二、医疗器械产品开展EO灭菌残留量检测的注意考量点!!!
三、GB/T 16886.6-2015《医疗器械生物学评价第7部分:环氧乙烷灭菌残留量》
划重点啦~
范围
* 不包括不与患者接触的经EO灭菌的器械,没有规定乙二醇(EG)的限量
概述
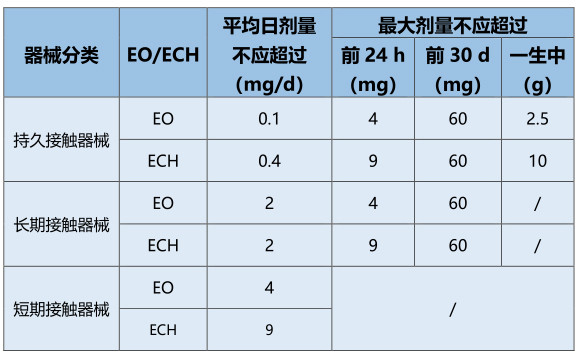
器械分类:按接触时间
* 如果材料或器械兼属于一种以上的时间分类,宜采用更为严格的试验和/或评价考虑。对于多次接触的器械,宜考虑潜在的累积作用和总的接触时间。
允许限量:持久接触和长期接触器械的限量以最大平均日剂量表述,还要遵循前24 h接触期的附加限定,以及对持久接触器械要遵循前30 d接触期的附加限定;表面接触器械和植入物的限量用可耐受接触限量表示,按照患者-器械相互接触面积计;对多器械系统,应对每个患者接触的器械规定限量。

EO和ECH残留量测定:包括从样品中浸提残留物、测定残留物的数量、测定器械的接触表面、以及分析和解释数据。应使用确认过的浸提和测定方法测定患者所接受的EO及ECH(必要时)的量值。
► 模拟使用浸提法(标准方法):模拟使用水溶液浸提,是唯一直接产生规定限量可比结果的方法。
► 极限浸提法(可接受的替代方法):一种可接受的替代方法,能提供有用的信息,其测得的结果表示大于或等于患者可以接受的剂量。
产品放行:当产品满足了对EO和ECH(如果适用)的要求。对成批EO灭菌产品的放行,应使用以下两个方法中的一个。
四、苏大EO灭菌残留量项目经验案例
【原文来源】GB/T 16886.7-2015
【全文整理】苏州大学卫生与环境技术研究所
【声明】如果您认为我们的内容或来源标注与原文不符,请告知我们,我们将与您积极协商解决。谢谢大家的关注。