IS0 10993《医疗器械生物学评价》系列标准,旨在为医疗器械开发过程中的风险管理和整体性生物学评价提供准则和指南,从而保护使用者免受潜在的生物风险和危害。IS0 10993-1作为第一部分重要的纲领性文件,为生物安全评估提供了一般原则,也为结构化评估方案提供了一个框架。
本文试图通过IS0 10993-1最新版本解读,为大家更好理解和正确使用这个标准提供帮助。
一、本版的主要内容变化阐述:
►修订附录A“生物风险评估中要解决的终点”,新增了“物理化学信息、材料热原、慢性毒性、致癌性、生殖和发育毒性和降解”的选项栏,矩阵中“物理化学信息”用“X”标识,为必做项目;其他项目用“E”标识,作为需要考虑的评价终点;
►附录B“风险管理过程指南”用 “基于风险管理过程的生物学评价指南”取代(原ISO TR 15499);
►增加ISO 10993系列标准中通用的名词术语;
►增加“非接触医疗器械”和“短暂接触医疗器械”评价信息;
►增加纳米材料和可吸收材料评价信息;
►增加参考文献ISO 18562(全系列标准)“医疗应用中呼吸气路生物相容性评价”;
二、术语和定义变化
►该部分变化很大,将原有的5个术语和定义进行了更新,并新增21个,新增术语和定义主要内容为:
三、生物学评价基本原则变化
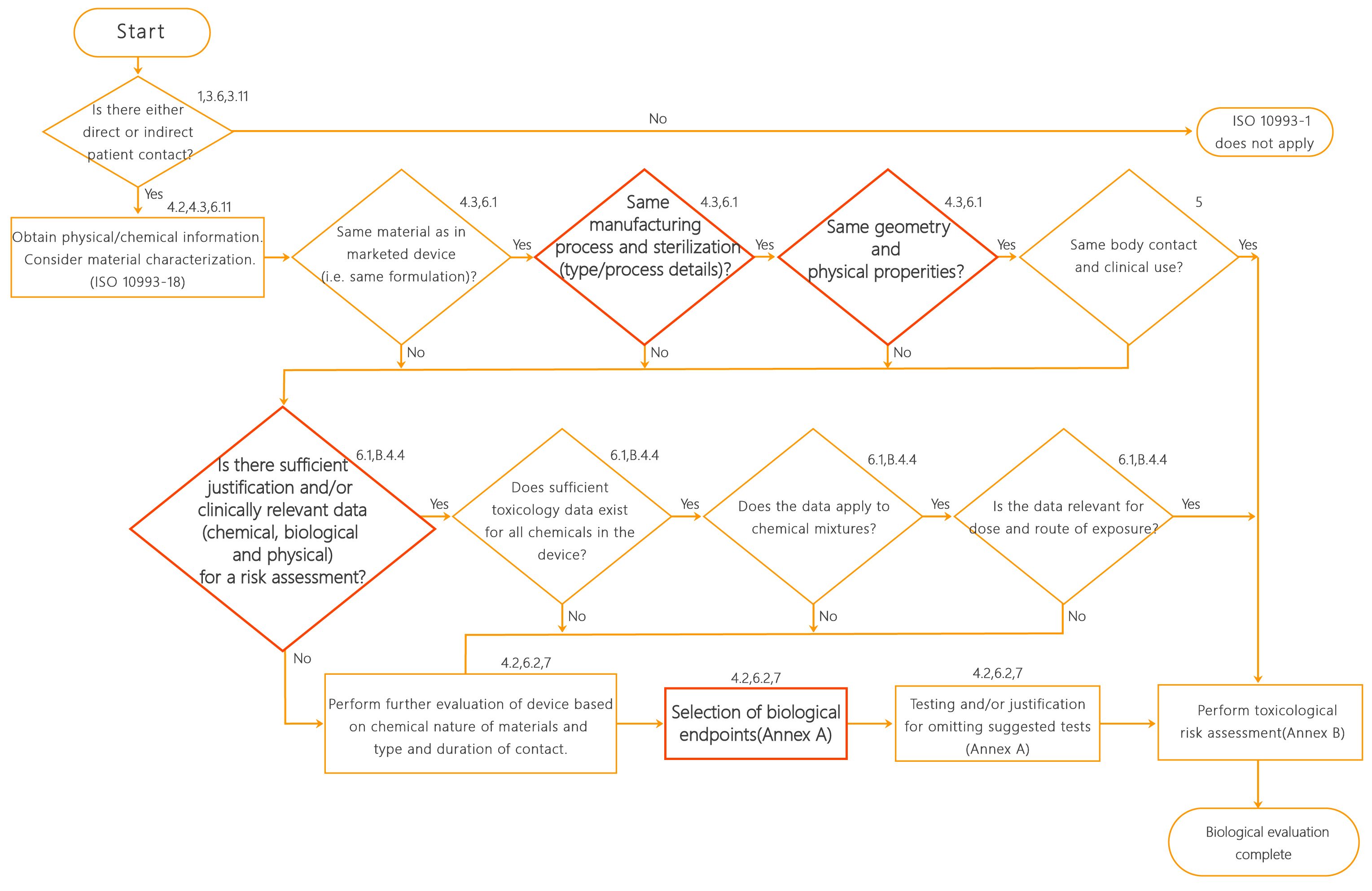
►更新了4.1 中的生物学评价系统方法流程图,将“获得材料识别信息,要考虑化学表征”改为“获得物理/化学信息,考虑材料表征”;删除“化学成分是否相同”,增加物理表征“几何和物理性质是否相同”(见图1)。此修订意味着,产品的物理/化学特性已成为生物学评价的基本内容。同时,新版标准强调:如果材料表征证明目标产品与已评价过确认安全的医疗器械和材料等同(具体参照ISO 10993-18和ISO 10993-19),且有足够的信息对材料/医疗器械进行风险评估时,通常没有必要进行测试。
►4.3章节新增加了对于包装材料的考虑因素。直接或间接接触医疗设备的包装材料可以将化学物质转移到医疗器械上,然后间接地影响病人或医生,例如包装上的标签和油墨等。根据新版标准要求,需要考虑包装材料在货架期内,是否会影响医疗器械的安全性。对于纳米材料医疗器械,例如含有纳米涂层的介入类器械,由于具有潜在的独特特性,因此需要按照ISO/TR 10993-22:2017《纳米材料指南》进行研究和生物学评价。新标准明确强调:医疗器械风险评估应同时考虑局部和系统的影响。
►4.7章节为新增条款----生产商对医疗器械的生物安全评价应覆盖医疗器械全生命周期。此规定引入了全生命周期的生物学评价,即除了研发阶段和临床前的生物学评价,临床试验直至产品退市阶段产生的所有数据,都将成为生物学评价报告更新的必要输入。
►4.8章节为新增条款----对于可重复使用医疗器械,应对制造商确认过的最大使用次数进行生物安全评价,这也是风险分析和管理的正确应用。
►4.11章节为新增条款,对该标准中的基本原则进行了标准符合性说明:
任何医疗器械涉及4.9条款中描述的变更发生,必须按照新版标准进行生物风险再评价。
四、医疗器械分类变化
►在5.1章节添加了2项举例说明:对于一个包括植入物和仅在手术过程中使用的输送系统两部分的医疗器械,考虑人体接触时间不同,植入物应该与输送系统分开评估。另外明确了间接接触的气路类医疗器械,其生物学评价的类型参照ISO 18562系列标准进行。
►在5.2.1章节新增了非接触类医疗器械,明确非接触类医疗器械不需要进行生物相容性检验,比如医学诊断软件、体外诊断设备以及采血管等。
►在5.2.2章节新增了备注解释,明确采用常规消费品原材料并与完整皮肤接触器械,无需更多的生物学评价。例如人机接触的电子设备(键盘、按钮、触摸屏、SD 卡、U 盘等)和与任何完整的皮肤接触的电子监视器或程序板(如手机、平板电脑等电子设备)或者与保护手套接触的器械(如导管的手柄)等。
►在5.2.3章节新增一类虽不与组织/骨接触,但用于向组织或骨输送液体的导管类器械,也划分为外部接入器械,如灌注导管等。
►在5.2.4章节将“主要与血液接触的器械”范围更新为“主要与心血管系统中循环血液接触的器械”,使之更加科学准确。同时增加备注:虽然很多组织含有循环血液,但这个分类并不包含植入此类组织的器械,例如疝气修补植入物。
►在5.3章节将“永久接触(permanent)”替换成“长期接触(long-term)”,使表述更加严谨。因为有些长期植入类器械,由于某些原因只能维持几年就需要重新更换,并不能算作永久植入,例如心脏起搏器或冠脉支架等。其次新增了短暂接触医疗器械的分类,即规定接触时间小于 1 分钟的器械。短暂接触医疗器械通常不需要进行生物相容性检验,也未列入附录 A,但此类器械若涉及累积使用,则需要另外评价。
五、生物学评价过程变化
►新版6.1“材料表征”替换为“用于生物风险分析的物理化学信息”,“化学表征”修订成“物理/化学表征”,并且强调在生物学评价和材料表征之前,必须收集器械/组件的物理和化学信息。此类信息的获取是生物学评价的第一步,并为材料表征和数据组提供产品信息依据。除了前版要求“所有材料、化学物质和工艺的结合在预期应用中使用安全”外,增加了“物理性质没有改变”才有可能豁免,并且需要文档记录豁免理由,以便追溯。对于磨损可能产生微粒的器械/组件,必须按照ISO/TR 10993-22:2017《纳米材料指南》进行纳米微粒的研究。
►新版6.2最重要的是附录A的修订,现解读如下:
►新版6.3条款或术语名称更合理规范。有关生物单项测试的修订解读如下:
六、总结
之前小编已为大家带来16886系列的全部内容,现将它们全体聚齐,排排站好,请您检阅:???
【原文来源】IS0 10993-1 2018
【全文整理】苏州大学卫生与环境技术研究所
【声明】如果您认为我们的内容或来源标注与原文不符,请告知我们,我们将与您积极协商解决。谢谢大家的关注!