是否原创:是
摘要:FDA标准和符合性评估计划的介绍
合集:#FDA
近日,FDA更新了标准和符合性评估计划(Standard and Conformity Assessment Program, S-CAP),旨在促进患者安全、推动监管科学的发展,支持最小负担监管框架。S-CAP 利用产品开发、符合性评估和标准团体的专业知识,促进标准制定和应用方面的合作。
S-CAP通过推动医疗器械、辐射产品和新兴技术自愿性共识标准的制定、认可和适当使用,支持FDA的使命。符合相关标准可提高监管审查的效率和质量。S-CAP:
P 制定并实施明确的政策,以促进在监管过程中适当使用标准;
P 预测并领导国家和国际共识标准的制定工作;
P 推进各项举措,增强符合性评估活动的信心;
P 促进技术创新和标准化,为患者使用新型器械提供便利;
P 通过推广和全球协调,在标准质量和使用方面发挥领导作用。
由此可知,S-CAP的重点为自愿性共识标准和符合性评估。根据ISO/ IEC Guide 2 Standardization and related activities – General vocabulary, 标准的定义是"......经协商一致制定并由一个认可机构批准的文件,它为活动或其结果提供共同和重复使用的规则、准则或特征,目的是在特定情况下实现最佳秩序。自愿性共识标准是由国内外标准制定组织 (Standards Development Organization,SDO) 根据严格的共识原则制定或采用的标准。基于共识的SDO必须遵守透明度、利益相关者的开放参与、代表平衡和正当程序等原则,因此共识标准有助于提高监管质量。
符合性评估:严格的符合性评估是一个强有力的监管框架不可分割的一部分,其中包含对共识标准的适当使用。OMB(Office of Management and Budget)将符合性评估定义为"......直接或间接证明与产品、流程、系统、个人或机构有关的特定要求已得到满足。符合性评估包括抽样和测试、检验、供应商符合性声明、认证以及管理体系评估和注册,还包括对这些活动能力的认可。
FDA标准认可过程
实施S-CAP的前提是对标准进行认可。FDA标准认可计划用于评估共识标准是否适用于审查医疗器械的安全性和性能。整个CDRH的技术和临床人员参与标准的制定和评估,并帮助S-CAP做出正式认可、全部或部分认可、或不认可共识标准的决定。制造商可提交符合FDA认可的共识标准的声明,若使用得当可减少上市前提交文件中通常需要的支持性测试文件的数量。
认可是FDA确定标准的过程,医疗器械制造商可根据这些标准提交符合性声明,以证明其符合FD&C Act中的相关要求。FDA可认可国家或国际SDO制定的全部、部分标准或不认可任何标准。任何利益相关方均可向FDA提交认可申请。
总体而言,FDA会积极评估新的共识标准和现有标准的修订对上市前审查程序的影响,并酌情认可这些标准。当FDA确定新的或修订的标准满足FD&C Act对医疗器械的要求时,便进行认可共识标准数据库的更新、发布认可编号并提供补充信息表。若FDA在联邦公报上公布认可清单,则认定为正式认可标准,认定活动通常每年至少进行两次。指南Recognition and Withdrawal of Voluntary Consensus Standards: Guidance for Industry and Food and Drug Administration Staff从4个方面对标准认可程序进行改进:
P 根据法规,FDA打算在60天内对所有认可请求做出答复;
P 根据法规,FDA将公布做出认可和不认可决定的理由;
P 在适当情况下,FDA可确定新标准、修订标准或被取代标准的过渡期;
P 当某项标准被输入FDA认可的共识标准数据库时,制造商将获准在上市前提交的文件中使用该标准作为符合性声明,而无需等待联邦公报公布对认可标准清单的修改。
若利益相关方需进行标准认可申请,须提供以下信息:
通过邮寄方式提交一份纸质复印件至CDRH标准计划处或电子发送邮件至CDRHStandardsStaff@fda.hhs.gov,具体邮寄地址如下:
Standards and Conformity Assessment Program
Office of Strategic Partnerships and Technology Innovation
Center for Devices and Radiological Health
10903 New Hampshire Avenue
WO66
Silver Spring, MD 20993-0002
FDA自收到申请之日起60个日历日内做出认可(全部或部分)或不认可共识标准的决定。做出决定后,FDA将通过提供的邮寄地址或提供的电子邮件地址向提交者发出决定书。若FDA更新“认可共识标准数据库”,则代表其支持完全认可或部分认可,并将说明理由。FDA将为每项认可标准提供一份补充信息表(Supplemental Information Sheet, SIS)。若适用,SIS将说明修订或取代的标准是否有过渡期。该标准被纳入数据库之后,制造商可在医疗器械申报符合性声明时使用。FDA还将在《联邦公报》上宣布认可该标准全部或部分的决定。
如何查找FDA认可和非认可标准
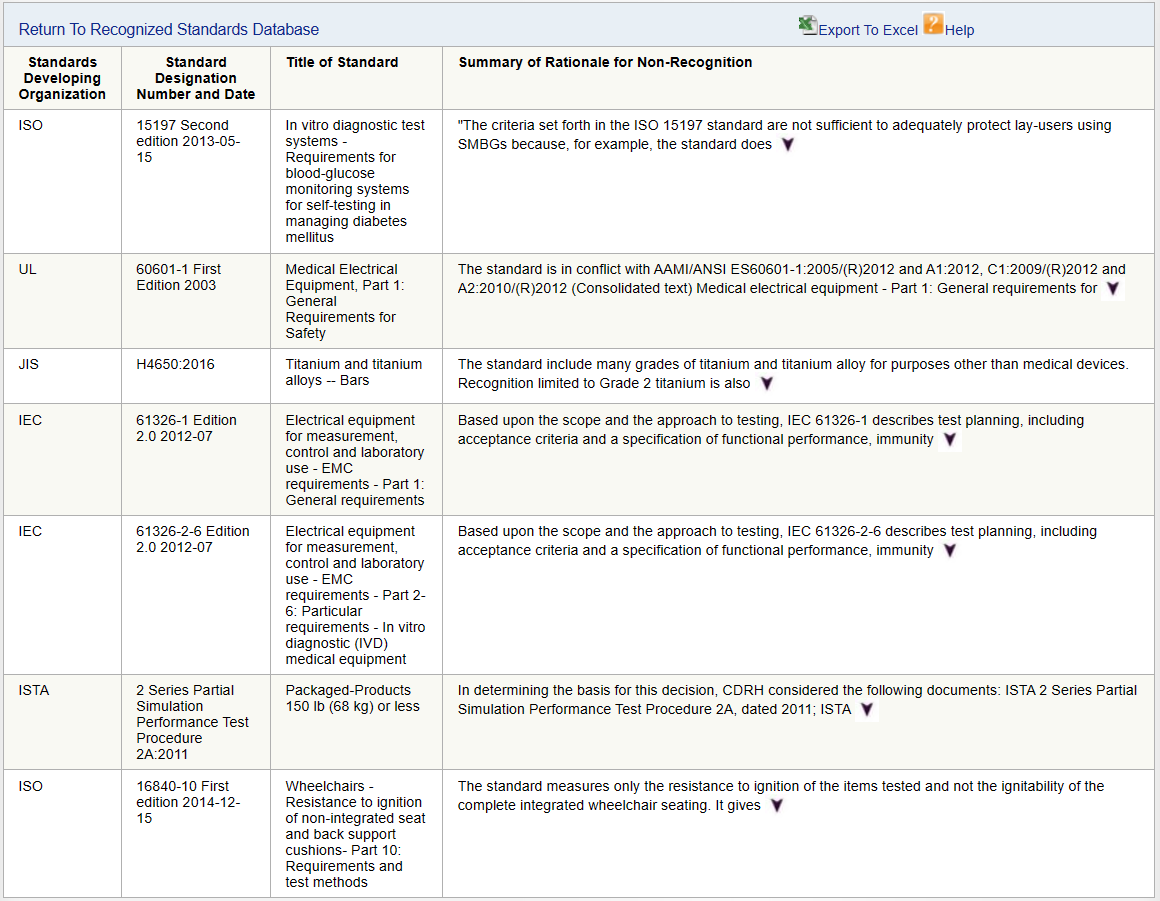
既然存在FDA认可标准,相应也有非认可标准。已获FDA认可(全部或部分)的标准在FDA的认可共识标准数据库中进行维护和搜索。已做出非认可决定的标准列于非认可标准数据库。尽管非认可共识标准在一般用途类别下可使用,但制造商不得提交非认可(或已被取代或撤销)标准的符合性声明。下图为目前为止不被认可的标准列表:
(2.1)
制造商应如何在上市前申请中适当使用共识标准以简化上市前审查程序?
虽然FDA鼓励制造商在其上市前申报材料中使用FDA认可的共识标准,但是否符合标准是自愿的,除非某项标准被 "参照纳入"法规。证明符合FDA认可的标准有利于上市前审查过程,包括任何 510(k)、De Novo、IDE、PMA、PDP、 HDE、IND,BLA申请。当FDA认可的共识标准可作为特定医疗器械的完整性能标准时,则标准尤其有用。符合其他更通用的标准,如特定器械的标准(未能覆盖器械性能的所有方面),也可简化上市前审查程序。
申请者应在其CDRH上市前审查申请封面表(FDA 3514 表)中适当地标明任何引用的标准,从而清楚地表明其在上市前申请中使用了标准。若制造商选择符合一个或多个FDA认可的共识标准以满足上市前审查的部分要求,则该制造商可提交符合标准的 "符合性声明"(221 U.S.C.360d(c)(1)(B)),更多信息可参考指南文件Appropriate Use of Voluntary Consensus Standards in Premarket Submissions for Medical Devices.
符合性评估认可方案
符合性评估认可方案(Accreditation Scheme for Conformity Assessment, ASCA),CDRH扩大了其标准计划,将与合格的认证认可机构和检测实验室合作开展的符合性评估计划纳入其中。ASCA计划旨在提高FDA对制造商符合性声明文件的信心,从而改进器械审查程序。根据《FDA User Fee Reauthorization Act of 2022》对第 514 条的修订,ASCA得到了FD&C Act第 514(d)条的授权。FDA已发布了三份最终指导文件,概述了该计划的细节。
自愿性ASCA计划应减少FDA要求提供有关测试方法的额外信息的需要,前提是上市前提交的材料包括符合FDA认可的符合ASCA纳入条件的共识标准的声明。ASCA 的最终目的是帮助FDA确保患者能够及时、持续地获得安全、有效和高质量的医疗器械。
参考资料:Standards and Conformity Assessment Program | FDA
【供 稿】苏大检测医疗器械事业部法规中心



