非原创
摘要:1月NMPA、CMDE等官方机构发布的法规通告汇总
公告
1.【CMDE】创新医疗器械特别审查申请审查结果公示(2024年第1号) - 2024.1.22
依据国家药品监督管理局《创新医疗器械特别审查程序》(国家药监局2018年第83号公告)要求,创新医疗器械审查办公室组织有关专家对创新医疗器械特别审查申请进行了审查,拟同意以下申请项目进入特别审查程序,
现予以公示。
申 请 人:北京爱康宜诚医疗器材有限公司
2.产品名称:青光眼引流器
申 请 人:海思盖德(苏州)生物医学科技有限公司
3.产品名称:心脏脉冲电场消融系统
申 请 人:深圳北芯医疗科技有限公司
4.产品名称:介入式心室辅助系统
申 请 人:心擎医疗(苏州)股份有限公司
5.产品名称:眼部肌肉神经刺激器
申 请 人:超目科技(北京)有限公司
6.产品名称:内窥镜单孔手术系统
申 请 人:直观医疗公司
7.产品名称:Nd:YAG三倍频激光斑块减容设备
申 请 人:深圳市中科融光医疗科技有限公司
公示时间:2024年1月22日至2024年2月4日
公示期内,任何单位和个人有异议的,可以书面、电话、邮件等方式向我中心综合业务部反映。
联 系 人:张欣
电话:010-86452928
电子邮箱:gcdivision@cmde.org.cn
地址:北京市海淀区气象路50号院1号楼
特别说明:进入创新审查程序不代表已认定产品具备可获准注册的安全有效性,申请人仍需按照有关要求开展研发及提出注册申请,药品监督管理部门及相关技术机构将按照早期介入、专人负责、科学审查的原则,在标准不降低、程序不减少的前提下进行审评审批。
原文链接:创新医疗器械特别审查申请审查结果公示(2024年第1号) (cmde.org.cn)
2. 【CMDE】关于发布远程监测系统注册审查指导原则的通告(2024年第5号)- 2024.1.18
为规范远程监测系统产品的注册申报和技术审评,国家药监局器审中心组织制定了《远程监测系统注册审查指导原则》,现予发布。
特此通告。
原文链接:国家药监局器审中心关于发布远程监测系统注册审查指导原则的通告(2024年第5号) (cmde.org.cn)
3.【CMDE】关于发布医疗器械真实世界研究设计和统计分析注册审查指导原则的通告(2024年第3号)- 2024.1.15
为进一步引导医疗器械真实世界研究的规范开展,国家药监局器审中心组织制定了《医疗器械真实世界研究设计和统计分析注册审查指导原则》,现予发布。
特此通告。
原文链接:国家药监局器审中心关于发布医疗器械真实世界研究设计和统计分析注册审查指导原则的通告(2024年第3号) (cmde.org.cn)
4.【CMDE】发布医疗器械注册审查指导原则目录 – 2024.1.9
近年来,我国医疗器械指导原则体系建设工作成效明显,指导原则的质量和数量明显提升,指导原则结构布局不断优化。截至2023年底,我国指导原则制修订数量已达613项(详见原文链接),全方位、多角度地发挥对注册申报和技术审评的指导作用。器审中心将继续坚持努力提升指导原则的科学性、前瞻性和引领性。筑牢审评科学的技术文件根基,从而推动医疗器械监管效能,进一步助力、引导医疗器械产业高质量发展。
原文链接:医疗器械注册审查指导原则目录 (cmde.org.cn)
5.【NMPA】发布医疗器械标准目录(截至2024年1月15日)- 2024.1.15
原文链接:医疗器械标准目录( 截至2024年1月15日) (nmpa.gov.cn)
6. 【江苏省药品监督管理局】第二类医疗器械创新产品注册申请审查结果公示(2024年第2号)-2024.1.29
依据《江苏省第二类医疗器械创新产品注册程序(试行)》要求,经审查,拟同意以下申请项目进入创新产品注册程序,现予以公示。
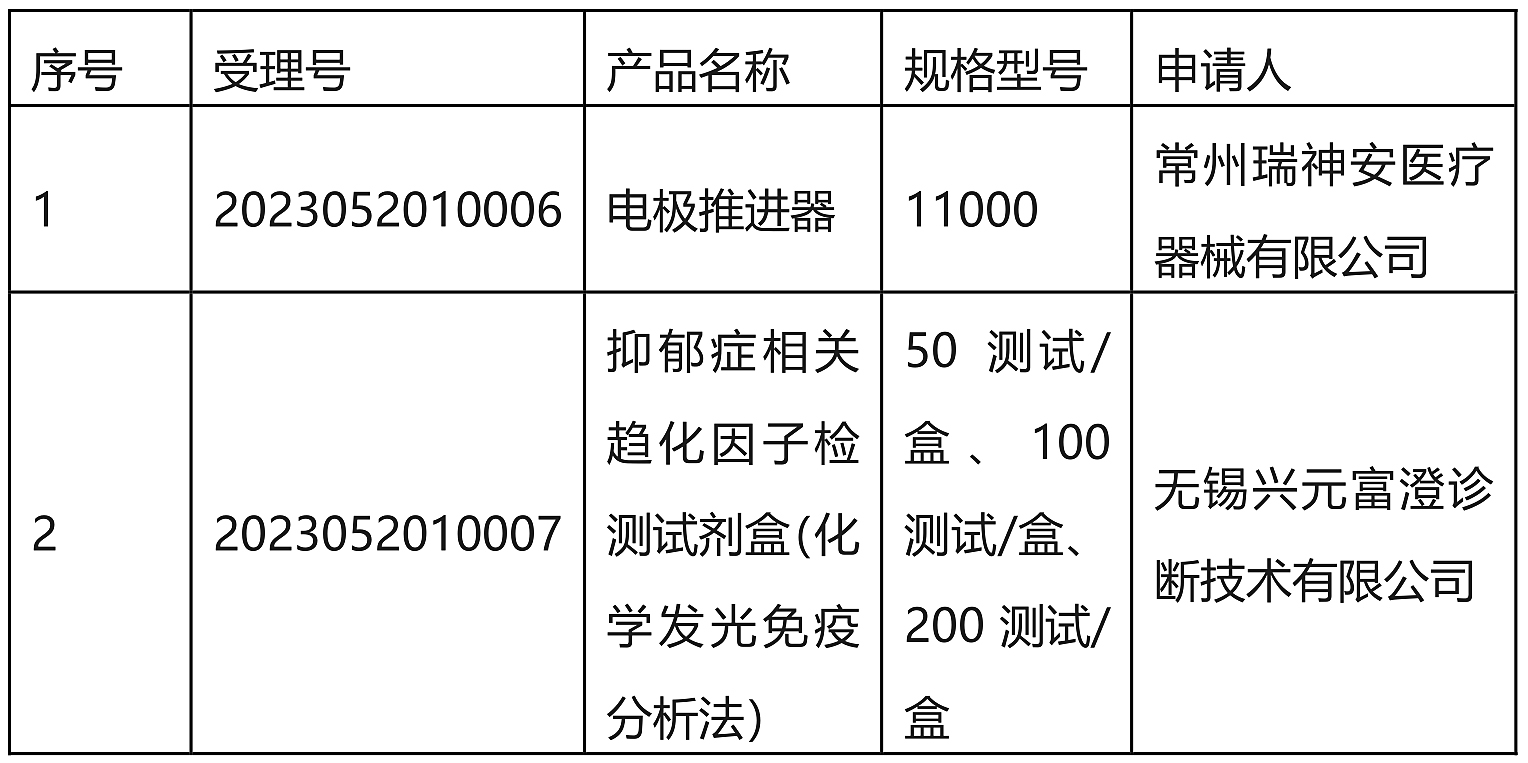
公示时间:2024年1月29日至2月8日
公示期内,任何单位和个人有异议的,可提交签字或盖章后的《江苏省第二类医疗器械创新产品注册审核异议表》(邮寄或发送邮件)。
电话:025-69655986
邮寄地址:南京市建邺区康文路17号,邮编:210019
电子邮箱:cxfwz@jsmdt.org.cn
原文链接:第二类医疗器械创新产品注册申请审查结果公示<br/>(2024年第2号) (jiangsu.gov.cn)
7. 【江苏省药品监督管理局】发布省药监局审评核查分支机构联系方式 – 2024.1.16
一、审评核查分中心联系方式
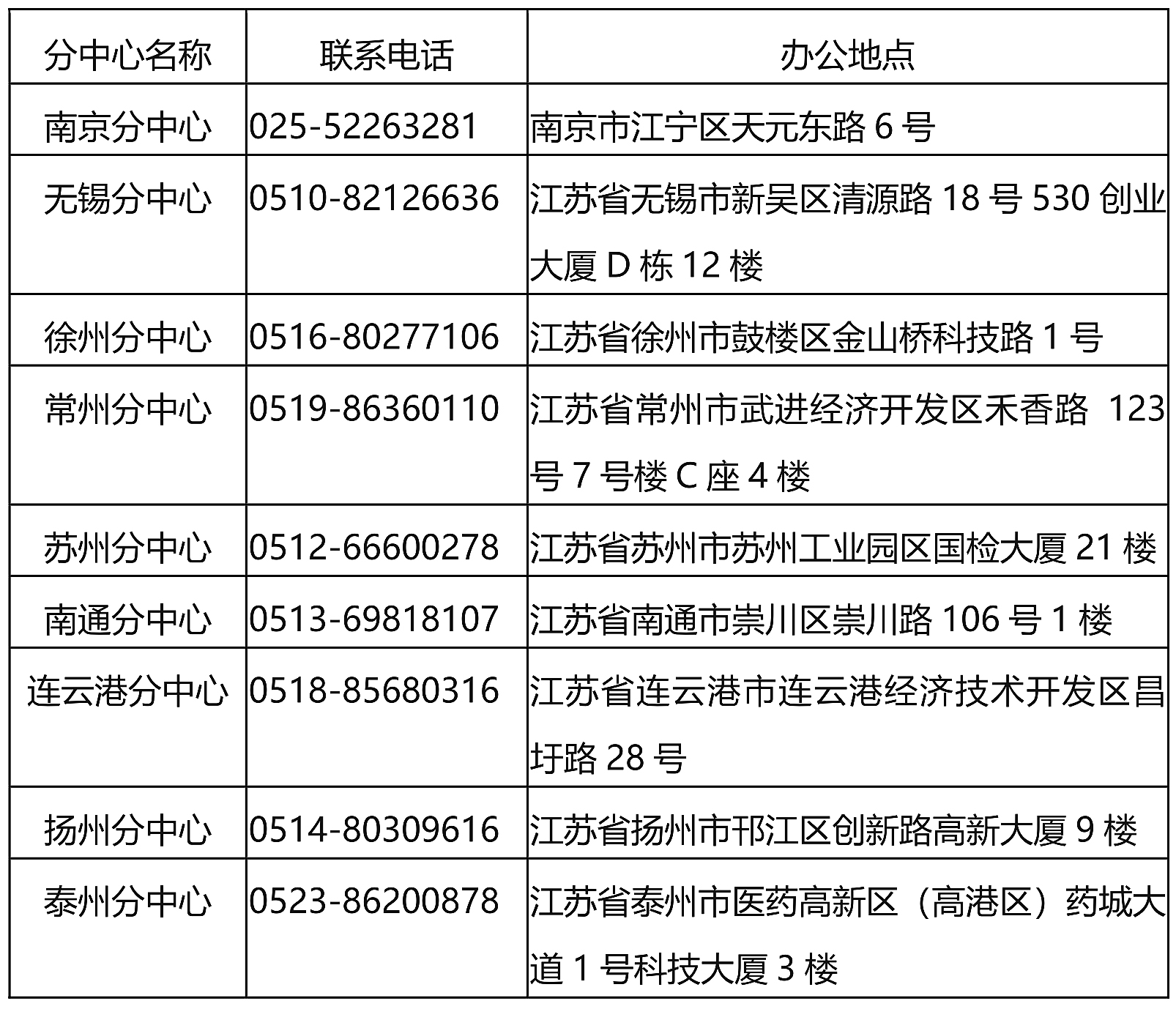
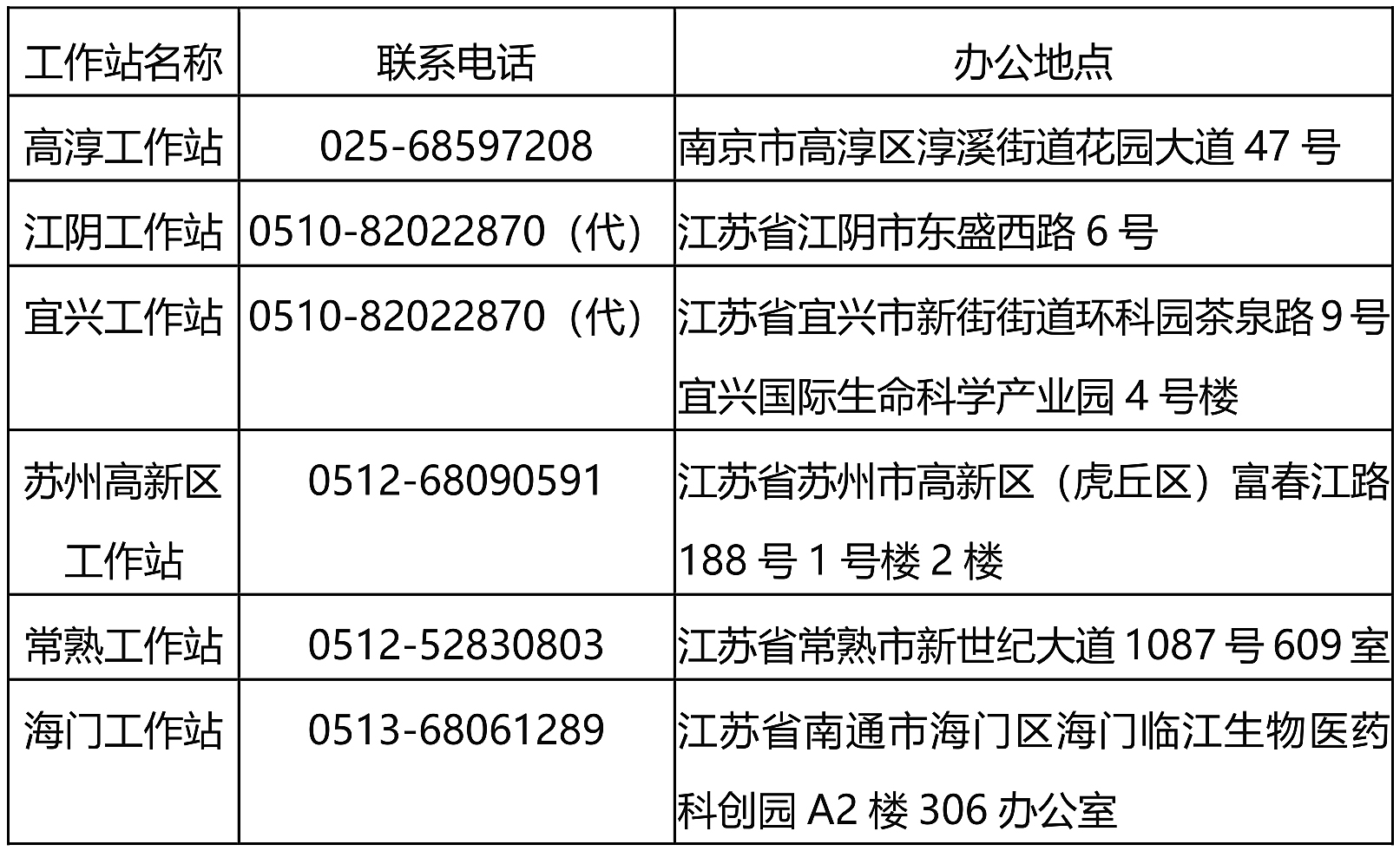
二、审评核查工作站联系方式
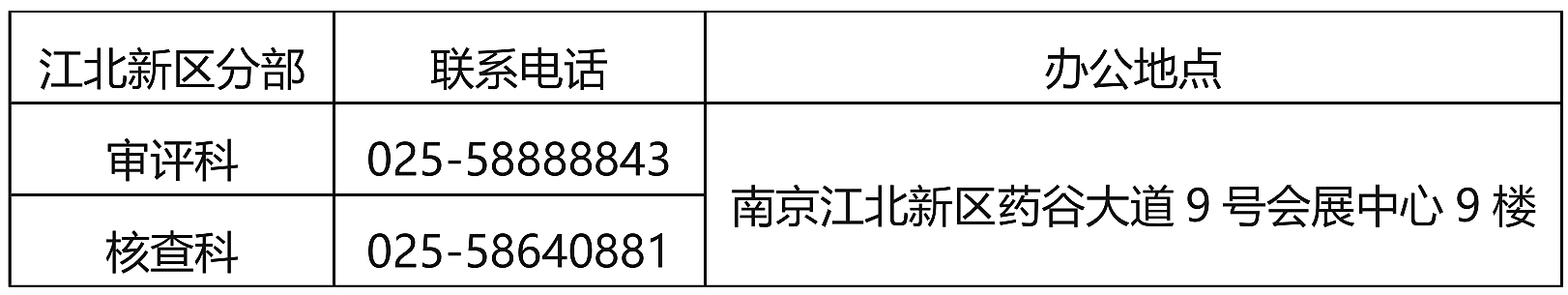
三、审评核查南京江北新区分部联系方式
原文链接:省药监局审评核查分支机构联系方式 (jiangsu.gov.cn)
征集
各有关单位:
根据国家药品监督管理局2023年度医疗器械注册审查指导原则制修订计划的有关要求,我中心组织修订了《眼科超声乳化和玻璃体切除设备及附件注册技术审查指导原则(2023年修订版)》,经调研、讨论,现已形成征求意见稿(附件1),即日起在网上公开征求意见。
如有意见和建议,请填写意见反馈表(附件2),以电子邮件的形式于2024年2月22日前反馈至我中心。邮件主题及文件名称请以“超乳导则意见反馈+反馈单位名称”格式命名。
联系人:曹越
联系方式:010-86452644
电子邮箱:caoyue@cmde.org.cn
原文链接:关于公开征求《眼科超声乳化和玻璃体切除设备及附件注册技术审查指导原则(2023年修订版)》意见的通知 (cmde.org.cn)



