非原创
摘要:4月NMPA、CMDE等官方机构发布的法规通告汇总
公告
为做好医疗器械注册受理前技术问题咨询工作,指导行政相对人安排咨询时间,保证咨询工作质量,现就近期咨询工作安排通告如下:
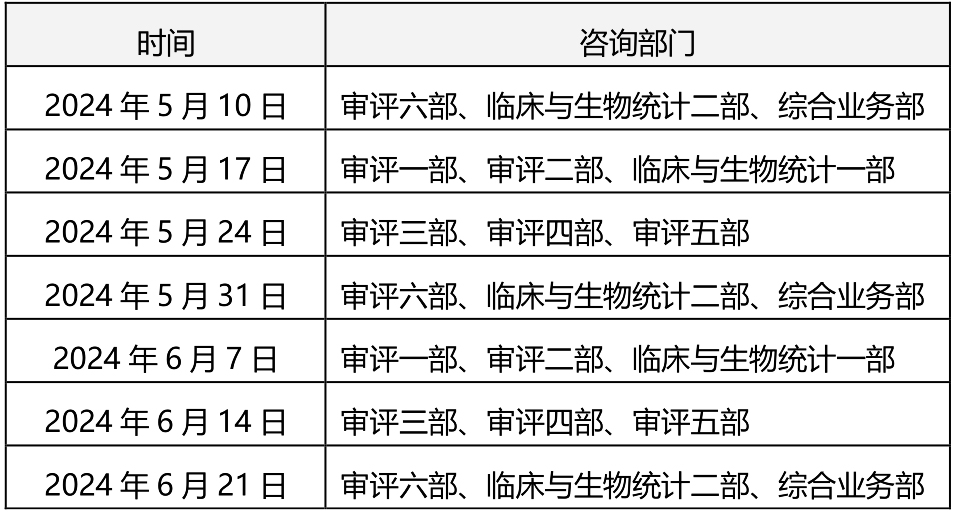
注:受理前咨询工作暂时采用视频会议方式进行,申请人预约成功后请等待电话通知。请申请人按照我中心2022年10月16日发布的《关于医疗器械受理前技术问题咨询工作安排调整的通告》(2022年第37号)的要求申请和办理,各受理前技术问题咨询参与单位咨询时间安排同器审中心,但不受轮值部门限制。
原文链接:关于2024年5月~6月医疗器械注册受理前技术问题咨询工作安排的通告(2024年第18号) (cmde.org.cn)
2019年5月,我中心启动了医疗器械注册电子申报信息系统(eRPS)配套使用的数字证书(以下简称“CA证书”)发放工作。为适应当前CA证书管理需求,优化CA证书相关工作流程,方便医疗器械注册申请人进行CA证书申领、信息变更、续费更新和补办等业务,对相关工作调整如下:
一、自2024年4月15日起,CA证书的管理等事宜整体移交至CA证书发放机构(北京数字认证股份有限公司)。CA证书申领、信息变更、续费更新和补办等业务,由医疗器械注册申请人自行至CA证书发放机构平台办理,相关费用由医疗器械注册申请人承担。
二、2024年4月15日前已在中心医疗器械注册电子申报信息系统提交CA证书申领的,以及在2024年4月15日前到期需续费更新的CA证书按原流程办理。
特此通告。
原文链接:关于调整医疗器械注册电子申报信息化系统(eRPS)数字证书管理方式的通告(2024年第16号) (cmde.org.cn)
为进一步加强医疗器械注册审查指导原则在注册申报和技术审评工作中的指导作用,我中心组织拟订了医疗器械注册审查指导原则编制计划(详见附件),现予以发布。希望医疗器械行业相关生产企业、行业协会、科研院所等单位关注我中心各项指导原则编制工作的具体通知或意见征集情况,积极参与医疗器械注册审查指导原则的制修订工作。
特此通告。
原文链接:关于发布2024年度医疗器械注册审查指导原则编制计划的通告(2024年第17号) (cmde.org.cn)
为进一步规范可吸收外科缝线医疗器械的管理,国家药监局器审中心组织制定了《可吸收外科缝线同品种临床评价注册审查指导原则》,现予发布。
特此通告。
原文链接:国家药监局器审中心关于发布可吸收外科缝线同品种临床评价注册审查指导原则的通告(2024年第15号) (cmde.org.cn)
2024年4月11日,国家药品监督管理局印发了2024年医疗器械行业标准制修订计划项目,涉及8项强制性行业标准,90项推荐性行业标准,详情请戳原文链接。
原文链接:国家药监局综合司关于印发2024年医疗器械行业标准制修订计划项目的通知 (nmpa.gov.cn)
2024年4月3日国家药品监督管理局发布关于进一步加强医疗器械注册人委托生产监督管理的公告(2024年第38号),从严格落实医疗器械注册人主体责任、切实强化医疗器械委托生产注册管理、持续加强委托生产监督管理三大方面进行要求,详情请戳原文链接。
原文链接:国家药监局关于进一步加强医疗器械注册人委托生产监督管理的公告(2024年第38号) (nmpa.gov.cn)
7. 【NIFDC】关于2024年第一次医疗器械产品分类界定结果汇总-2024.4.9
为贯彻落实《国家药监局关于进一步加强和完善医疗器械分类管理工作的意见》(国药监械注〔2023〕16号),进一步提升医疗器械分类管理服务水平,现公开2024年第一次医疗器械产品分类界定结果汇总。详情请戳原文链接。
原文链接:2024年第一次医疗器械产品分类界定结果汇总 (nifdc.org.cn)
征集
各有关单位:
根据国家药品监督管理局2024年度医疗器械注册审查指导原则制修订计划的有关要求,我中心组织编制了《藻酸盐敷料注册审查指导原则》,经文献调研、专题研讨等程序形成了征求意见稿(附件1),即日起在网上公开征求意见。
如有意见或建议,请填写反馈意见表(附件2),并于2024年6月5日前将意见反馈至联系人邮箱。
联系人:任英 赵艳红
电话:010-86452676 86452837
电子邮箱:renying@cmde.org.cn
原文链接:关于公开征求《藻酸盐敷料注册审查指导原则(征求意见稿)》意见的通知 (cmde.org.cn)
各有关单位:
按照《2024年度医疗器械注册审查指导原则编制计划》,中心已启动《腹腔内窥镜手术系统注册审查指导原则 第5部分: 系统与软件》编制工作。在已发布的《腹腔内窥镜手术系统技术审评要点(2023年修订版)》(附件1)基础上,对系统及软件部分(不含末端执行器)相关要求进行细化完善并形成指导原则。现公开征集意见和建议,欢迎相关领域的专家、学者及从业人员积极参与。
请参与指导原则研究工作的单位填写意见反馈表(附件2),于2024年5月17日前统一以电子邮件形式反馈。
联系人:张晨光、陈敏
联系电话:010-86452649、010-86452640
电子邮箱: zhangcg@cmde.org.cn
原文链接:关于公开征集《腹腔内窥镜手术系统注册审查指导原则第5部分:系统及软件》意见建议的通知 (cmde.org.cn)



