公告
为做好医疗器械注册受理前技术问题咨询工作,指导行政相对人安排咨询时间,保证咨询工作质量,现就近期咨询工作安排通告如下:
一、轮值部门时间安排:
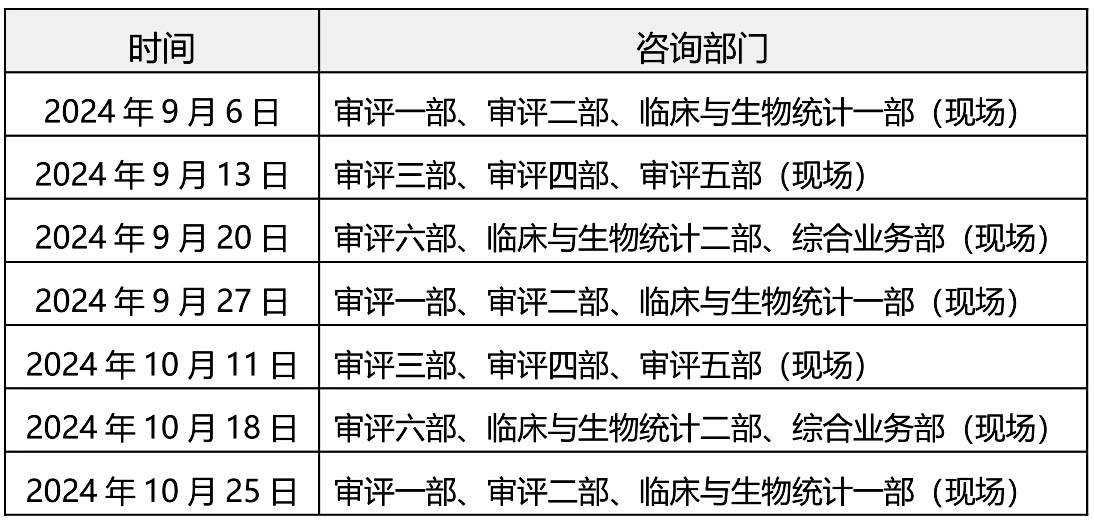
二、自2024年7月19日起,受理前技术问题咨询恢复为现场咨询,预约方式不变,按照中心2022年10月16日发布的《关于医疗器械受理前技术问题咨询工作安排调整的通告》(2022年第37号)的要求申请和办理。未预约现场咨询或预约未成功的单位,仍可选择邮件方式提交咨询申请。各受理前技术问题咨询参与单位咨询时间安排同器审中心,但不受轮值部门限制。
咨询时间:工作日每周五下午13:30至16:30(法定节假日除外)。
咨询地点:北京经济技术开发区广德大街22号院一区2号楼一层。
原文链接: 关于2024年9月~10月医疗器械注册受理前技术问题咨询工作安排的通告(2024年第25号) (cmde.org.cn)
为进一步规范水凝胶敷料等12类医疗器械的管理,国家药监局器审中心组织制修订了《水凝胶敷料注册审查指导原则》等12项注册审查指导原则,现予发布。
特此通告
原文链接: 国家药监局器审中心关于发布水凝胶敷料注册审查指导原则等12项医疗器械产品注册审查指导原则的通告(2024年第23号) (cmde.org.cn)
各有关单位:
为进一步全面助推我国医疗器械产业发展,充分发挥医疗器械创新服务站对所在区域医疗器械产业发展的技术支撑作用,现将河北省医疗器械创新服务站、山东省医疗器械创新服务站、湖北省医疗器械创新服务站作为参与单位纳入注册受理前技术问题咨询工作范围,自2024年8月12日起接收咨询申请,为区域内医疗器械生产企业提供更为优质高效的咨询指导。具体内容请点击原文链接。
原文链接:关于医疗器械受理前技术问题咨询工作安排调整的通告的补充通知 (cmde.org.cn)
2024年7月,国家药监局共批准注册医疗器械产品272个。其中,境内第三类医疗器械产品192个,进口第三类医疗器械产品44个,进口第二类医疗器械产品35个,港澳台医疗器械产品1个(具体产品见附件)。
特此公告。
原文链接:国家药监局关于批准注册272个医疗器械产品的公告 (2024年7月) (2024年第102号) (nmpa.gov.cn)
为进一步满足企业公众查询医疗器械监管信息的需要,强化社会监督与社会共治,国家药监局汇总了各省(自治区、直辖市)有效期内医疗器械产品注册备案、医疗器械生产企业许可备案、医疗器械经营企业许可备案、医疗器械网络销售备案、医疗器械网络交易服务第三方平台备案信息(附后),按月公布。具体数据可点击国家药监局数据查询页面医疗器械模块查询(https://www.nmpa.gov.cn/datasearch/home-index.html?itemId=2c9ba384759c957701759ccef50f032b#category=ylqx)。如对数据有疑问,请按网站数据库公布的纠错维护方式操作。
原文链接:各省医疗器械许可备案相关信息(截至2024年7月31日) (nmpa.gov.cn)
为进一步提升服务效率,优化企业办事体验,审评核查苏州分中心持续推进受理办理服务升级,提升办件质效,让企业办事更加快捷、高效,将便企利企服务落到实处。详细内容请点击原文链接。
原文链接:江苏省药品监督管理局 市县动态 “小窗口”托起“大服务”——省药监局审评核查苏州分中心便民服务再升级 (jiangsu.gov.cn)
征集
各有关单位:
为进一步做好医用电子加速器和伽玛(γ)射束放射治疗设备的技术审评工作,我中心计划开展《医用电子加速器注册审查指导原则》《伽玛(γ)射束放射治疗注册审查指导原则》的编制工作,现征集编制工作参与单位。希望具有相关经验的境内外企业、检验机构、科研机构、临床机构等积极参与编制工作。
请有意向参与编制工作的企业及单位填写信息征集表(详见附件),于2024年9月13日之前报送我中心。
联系人:贺丽萍
联系电话:010-86452614
电子邮箱:help@cmde.org.cn
附件:信息征集表(下载)
原文链接:关于征集医用电子加速器和伽玛(γ)射束放射治疗设备注册审查指导原则编制工作相关单位信息的通知 (cmde.org.cn)
各相关单位和个人:
根据全国医疗器械临床评价标准化技术归口单位(以下简称“归口单位”)2024年关于标准制定的工作安排,我归口单位已完成《医疗器械真实世界数据 术语和定义》《体外诊断试剂临床试验生物样本管理要求》等2项行业标准征求意见稿等相关材料,建议上述2项标准发布12个月后实施,现面向社会公开征求意见。
请相关单位组织人员对标准征求意见稿、编制说明(附件1-2)和建议实施日期提出意见或建议,填写《医疗器械标准征求意见反馈表》(附件3),于2024年10月8日前以电子邮件形式反馈至归口单位秘书处邮箱,邮件主题请注明标准名称。无意见也请邮件反馈说明。逾期未回复,视为无意见。
秘书处联系方式:
联系人:崔馨月(医疗器械)
电话: 010-86452502
邮箱: cuixy@cmde.org.cn
联系人:郑生伟(体外诊断试剂)
电话:010-86452541
邮箱:zhengsw@cmde.org.cn
附件:
1.《医疗器械真实世界数据 术语和定义》(征求意见稿)及编制说明(下载)
2.《体外诊断试剂临床试验生物样本管理要求》(征求意见稿)及编制说明(下载)
3. 标准征求意见反馈表(下载)
原文链接:关于公开征求《医疗器械真实世界数据 术语和定义》等2项行业标准意见的通知 (cmde.org.cn)
进一步加强医疗器械监督管理,保障医疗器械安全有效和促进产业高质量发展,更好满足人民群众对高质量医疗器械的需求,根据全国人大常委会立法规划,国家药监局研究起草了《中华人民共和国医疗器械管理法(草案征求意见稿)》,现向社会公开征求意见。欢迎社会各界积极提出意见建议,国家药监局将认真研究吸收,对于意见集中的问题,还将组织座谈交流和专题研究论证。有关意见建议可通过以下途径和方式反馈:
1.电子邮件反馈至zfsfgc@nmpa.gov.cn。发送邮件时,请在邮件主题处注明“《医疗器械管理法》公开征求意见反馈”。
2.信函邮寄至国家药品监督管理局政策法规司(北京市西城区展览路街道北露园1号,邮政编码100037),并请在信封上注明“《医疗器械管理法》公开征求意见反馈”字样。
意见反馈截止时间为2024年9月28日。
附件:
1.中华人民共和国医疗器械管理法(草案征求意见稿)
2.意见建议反馈表
原文链接:国家药监局综合司公开征求《中华人民共和国医疗器械管理法(草案征求意见稿)》意见 (nmpa.gov.cn)



