公告
1、【NIFDC】2024年第二次医疗器械产品分类界定结果汇总 – 2024.10.31
2、【江苏省药品监督管理局】关于江苏省药品监督管理局审评核查常州分中心增项赋权有关事项的公告(2024年第30号)-2024.10.28
为贯彻落实《省政府办公厅印发关于优化审评审批服务推动创新药械使用促进医药产业高质量发展行动方案(2022-2024年)的通知》(苏政办发〔2022〕1号)部署要求,根据《江苏省药品监督管理局审评核查分中心考核与赋权实施办法(试行)》,现决定自2024年10月30日起向江苏省药品监督管理局审评核查常州分中心赋权三类审评事项16项、三类核查事项34项(详见附件)。
特此公告。
原文链接:关于江苏省药品监督管理局审评核查常州分中心增项赋权有关事项的公告<br/>(2024年 第30号)
3、【CMDE】高端医疗装备创新合作平台官方网站正式上线 助力产业高质量发展- 2024.10.25
为进一步促进高端医疗装备产业高质量发展,加强供需两端的交流合作与资源整合,提升公众服务水平,在国家药品监督管理局的业务指导下,由国家药品监督管理局医疗器械技术审评中心管理的高端医疗装备创新合作平台(HMEICP)网站于2024年10月24日正式对外发布并上线运行。
高端医疗装备创新合作平台(HMEICP)的建立旨在助力国家战略,聚焦产业需求,不断健全强化高端医疗装备产业链发展体制机制,全力支持高端医疗装备产业高质量发展,构建“政、产、学、研、医”协同创新的合作体系,推动各方资源相互融合、互相促进、深入合作,共同解决关键核心技术问题和新技术转化难题,培育新质生产力, 为建设健康中国、保障人民群众用械安全提供有力支撑。
高端医疗装备创新合作平台网站包含了首页、平台动态、政策法规、高端医疗装备动态、工作组、成果发布、关于我们7个一级导航栏目,内容涵盖了平台组织架构、高端医疗装备信息、相关政策法规等多个方面。
平台将根据用户需求和行业发展,不断优化网站功能,持续更新政策法规及高端医疗装备动态信息,为用户提供一个全面、权威的信息交流和服务平台。
原文链接:高端医疗装备创新合作平台官方网站正式上线 助力产业高质量发展
4、【NMPA】关于发布国家医疗器械监督抽检结果的通告(2024年第42号)– 2024.10.25
为加强医疗器械监督管理,保障医疗器械产品质量安全有效,国家药品监督管理局组织对超声治疗设备、高频电刀等7个品种进行了产品质量监督抽检,有11批(台)产品不符合标准规定。
监管要求:对抽检发现的不符合标准规定产品,国家药品监督管理局已要求企业所在地省级药品监督管理部门按照《医疗器械监督管理条例》《医疗器械生产监督管理办法》《医疗器械召回管理办法》等规定,及时作出行政处理决定并向社会公布。省级药品监督管理部门要督促企业对抽检不符合标准规定产品进行风险评估,根据医疗器械缺陷的严重程度确定召回级别,主动召回产品并公开召回信息;督促企业尽快查明产品不合格原因,制定整改措施并按期整改到位。
特此通告。
原文链接:国家药监局关于发布国家医疗器械监督抽检结果的通告(2024年第42号)
5、【CMDE】关于发布乳房植入体产品注册审查指导原则(2024年修订版)的通告(2024年第28号)- 2024.10.17
为进一步规范乳房植入体医疗器械的管理,国家药监局器审中心组织修订了《乳房植入体产品注册审查指导原则(2024年修订版)》,现予发布。
特此通告
原文链接:国家药监局器审中心关于发布乳房植入体产品注册审查指导原则(2024年修订版)的通告(2024年第28号)
6、【NMPA】关于批准注册444个医疗器械产品的公告(2024年9月)(2024年 第128号) – 2024.10.16
2024年9月,国家药监局共批准注册医疗器械产品444个。其中,境内第三类医疗器械产品356个,进口第三类医疗器械产品56个,进口第二类医疗器械产品31个,港澳台医疗器械产品1个(具体产品见附件)。
特此公告。
原文链接:国家药监局关于批准注册444个医疗器械产品的公告(2024年9月)(2024年 第128号)
7、【CMDE】关于发布影像型超声诊断设备(第三类)注册审查指导原则(2023年修订版)的通告(2024年第29号)– 2024.10.14
为进一步规范影像型超声诊断设备医疗器械的管理,国家药监局器审中心组织制订了《影像型超声诊断设备(第三类)注册审查指导原则(2023年修订版)》,现予发布。
特此通告。
原文链接:国家药监局器审中心关于发布影像型超声诊断设备(第三类)注册审查指导原则(2023年修订版)的通告(2024年第29号)
8、【CMDE】关于2024年11月~12月医疗器械注册受理前技术问题咨询工作安排的通告(2024年第30号)- 2024.10.12
为做好医疗器械注册受理前技术问题咨询工作,指导行政相对人安排咨询时间,保证咨询工作质量,现就近期咨询工作安排通告如下:
一、轮值部门时间安排:
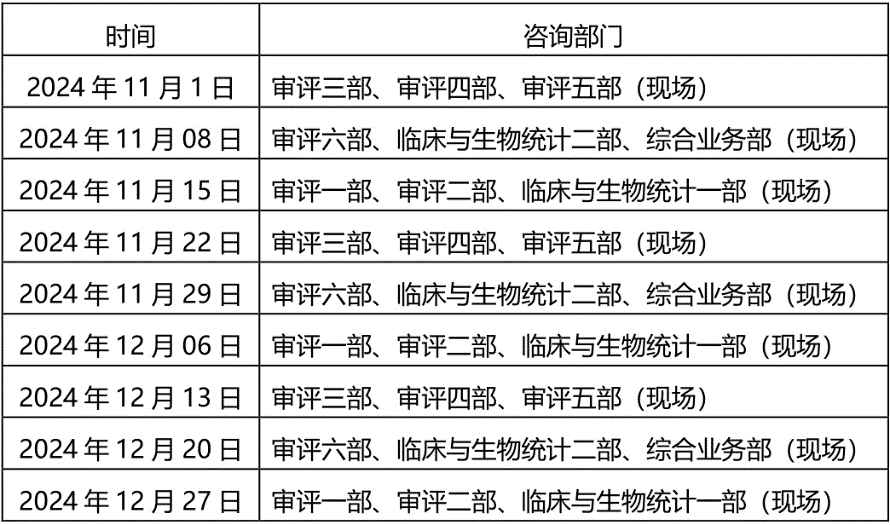
二、自2024年7月19日起,受理前技术问题咨询恢复为现场咨询,预约方式不变,按照中心2022年10月16日发布的《关于医疗器械受理前技术问题咨询工作安排调整的通告》(2022年第37号)的要求申请和办理。未预约现场咨询或预约未成功的单位,仍可选择邮件方式提交咨询申请。各受理前技术问题咨询参与单位咨询时间安排同器审中心,但不受轮值部门限制。
咨询时间:工作日每周五下午13:30至16:30(法定节假日除外),请申请人于下午3:00前取号。
咨询地点:北京经济技术开发区广德大街22号院一区2号楼一层。
原文链接:关于2024年11月~12月医疗器械注册受理前技术问题咨询工作安排的通告(2024年第30号)
9、【NMPA】关于发布YY 0271.2—2024《牙科学 水基水门汀 第2部分:树脂改性水门汀》等34项医疗器械行业标准的公告(2024年第120号)-2024.10.8
YY 0271.2—2024《牙科学 水基水门汀 第2部分:树脂改性水门汀》等34项医疗器械行业标准已经审定通过,现予以公布。标准编号、名称、适用范围和实施日期见附件。
特此公告。
原文链接:国家药监局关于发布YY 0271.2—2024《牙科学 水基水门汀 第2部分:树脂改性水门汀》等34项医疗器械行业标准的公告(2024年第120号)
征集
各有关单位:
根据国家药品监督管理局医疗器械注册技术指导原则制修订计划的有关要求,中心组织修订了《富血小板血浆制备器注册审查指导原则(征求意见稿)》,现向社会公开征求意见。
请相关领域的专家、学者、生产企业及有关从业人员提出宝贵意见和建议。相关意见或建议,请下载并填写附件中的《富血小板血浆制备器注册审查指导原则(征求意见稿)》反馈意见表,并于2024年11月20日前将反馈意见以电子邮件形式反馈我中心。
联系人:朱俊泰 蔡娜娜
电 话:010-86452878 ;010-86452873
电子邮箱: zhujt@cmde.org.cn;cainn@cmde.org.cn
原文链接:关于公开征求《富血小板血浆制备器注册审查指导原则(征求意见稿)》意见的通知



