近期,欧盟MDCG小组连发5份EMDN相关指南,其中三份为新发布,两份为修订。今天我们挑选MDCG 2021-12 Rev1《欧洲医疗器械命名法EMDN常见问题解答更新版》中能指导实际操作的一些问答供各位读者学习。

Q1:什么是EMDN?
根据MDR Art.26和IVDR Art.23规定,EMDN旨在支持欧洲医疗器械数据库(EUDAMED)的运作,用途包括:制造商使用该命名法在EUDAMED中注册医疗器械,并将其与每个UDI-DI相关联。EMDN主要用于对MDR和IVDR的监管,它在MDR/IVDR器械文件、技术文件、由公告机构进行的技术文件抽样检查、上市后监管与警戒以及上市后数据分析等方面发挥了关键作用。EMDN旨在支持所有参与者在MDR/IVDR下开展活动,并向患者提供关键器械说明,包括其自身器械及市场上可得的或在EUDAMED数据库登记的所有其他器械。
Q2:如何访问EMDN?
EMDN对所有利益相关方免费开放,可通过网址European Medical Device Nomenclature (EMDN)进行访问和下载。
Q3:如何构建EMDN?
EMDN采用七层级树状结构,由字母数字构成,将医疗器械分为三个主要层级:
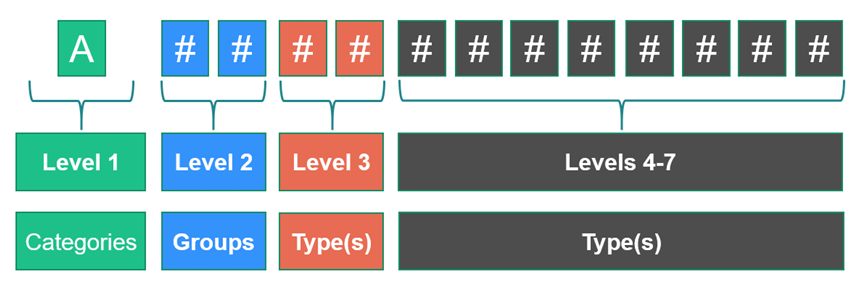
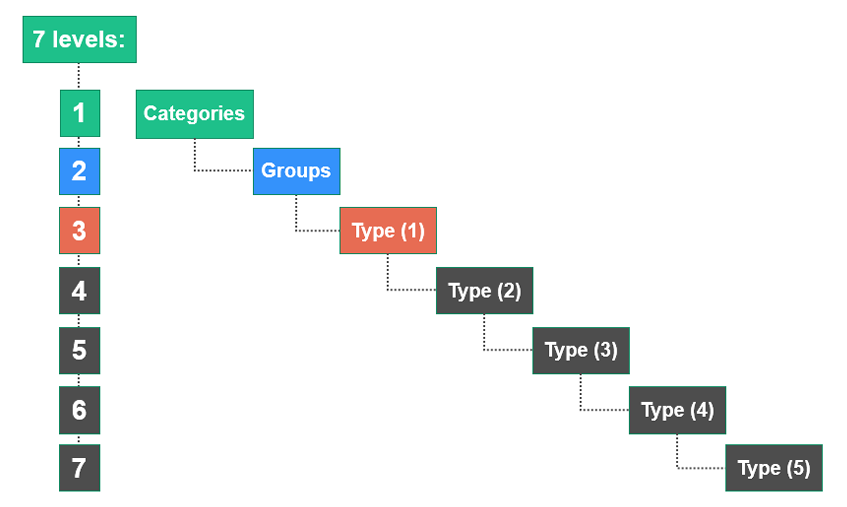 每个EMDN代码都以一个字母开头,表示该器械所属的“类别”,随后是两个数字表示“组”,接着是一系列数字表示“类型”。代码的最大位数为13位。每个代码都与一个术语相关联,为属于同一代码的器械提供简洁且精确的理解。每个层级都包含代码和术语。
每个EMDN代码都以一个字母开头,表示该器械所属的“类别”,随后是两个数字表示“组”,接着是一系列数字表示“类型”。代码的最大位数为13位。每个代码都与一个术语相关联,为属于同一代码的器械提供简洁且精确的理解。每个层级都包含代码和术语。
Q4:在EUDAMED中,为UDI-DI分配EMDN代码时,应使用哪一层级?
制造商须为其医疗器械分配树状结构中的最低层级,并将其与器械的UDI-DI相关联。
Q5:在EUDAMED中,每个UDI-DI可分配几个EMDN码?
一般情况下,制造商须为其器械的UDI-DI选择最合适的单一代码。如果器械具有多种预期用途,则可分配多个代码,例如具备多种诊断和治疗功能的复杂医疗器械系统。多个代码之间无优先级顺序排列。
Q6:如果找不到合适的EMDN术语,应该为器械UDI-DI分配什么EMDN代码?
制造商应始终在最低层级中搜索,以找到最适合器械UDI-DI的EMDN术语。只有当最低层级的术语还不能与器械的描述相匹配时,制造商才可将“99”(表示该层级类型中的”其他“)作为分配代码。但请注意,与代码”99“关联的UDI-DI将在年度EMDN审查程序中接收额外审查。
Q7:若没有合适的EMDN代码分配给器械UDI-DI,该如何处理?
Q8:用户如何了解已实施的EMDN变更?
关于所做变更(与上一版EMDN相比)的文档将于每年12月或1月与年度更新一起发布在MDCG认可的文件和其他指导文件网页上,目前无法直接向用户发送EMDN变更通知。
Q9:是否会设定时间框架,要求申请者/提交者必须在此时间内回应反馈/问题,以满足同一年度的处理时间要求?
申请者/提交者需要在收到EMDN技术团队邮箱请求后的15个工作日内进行澄清。如果澄清内容在截止日期之后到达,相关提案可能无法在同一年度内完成处理。
Q10:是否会定期审查与多个EMDN代码相关的器械,以确定是否需要创建新代码?
在年度EMDN更新程序中,与多个EMDN代码相关的UDI-DI将受到额外审查。例如,制造商为CT系统分配了一个代码,同时又为PET系统分配了第二个代码,那么可能会在审查中考虑为这种组合系统(如PET/CT)创建一个新的代码。
Q11:当EMDN发生变化(新代码、拆分代码、废弃代码)时,制造商何时需要更新相关代码?
制造商和公告机构(如适用)应在相关文档(如证书、符合性声明)和EUDAMED中及时且合理地反映此类更新,最迟在年度EMDN更新周期完成后下一次年度监督审核之前。由于不会进行单独通知,因此建议制造商将评估每年发布的EMDN更新作为标准做法,以便在年度监督审核之前通知公告机构可能影响其产品组合中器械的变更。
参考资料:MDCG 2021-12 Rev.1 FAQ on the European Medical Device Nomenclature (EMDN)



