2025年3月国际标准化组织(ISO)更新了ISO 15223-1:2021/Amd1:2025《医疗器械-制造商提供信息所使用的符号-第一部分-通用要求》。主要更新内容为:增加 “授权代表 ”的定义术语,修改 EC REP 符号。下面我们看看修订细节:
1.在术语部分新增条款3.20 授权代表及其定义。

2.替换条款5.1.2为以下内容。
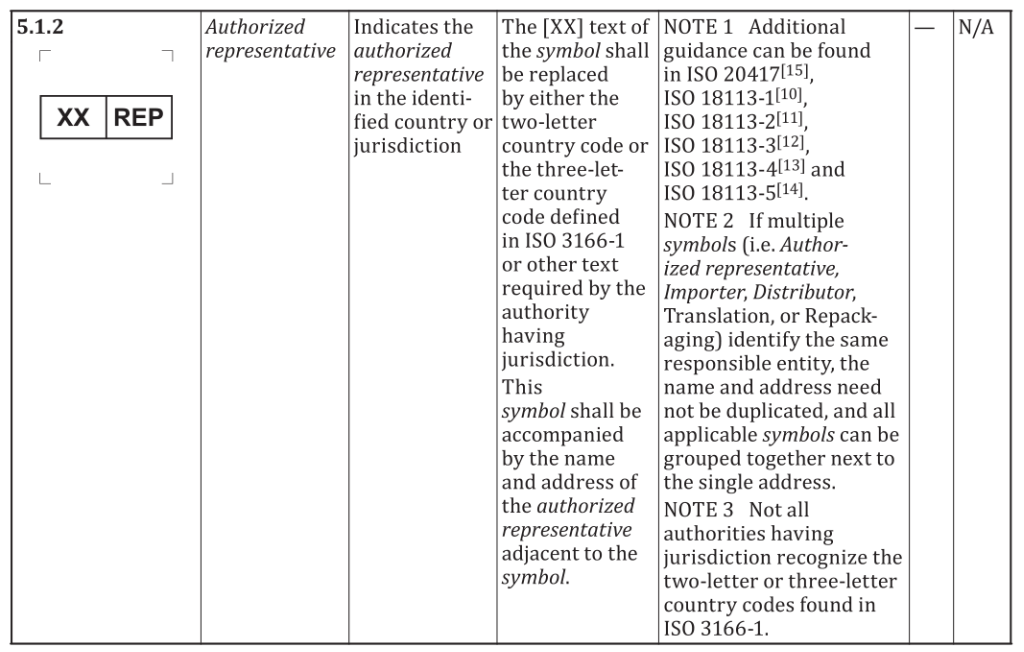
【XX】文本应替换为由 ISO 3166-1 中定义的二字母/三字母国家代码或有管辖权
的当局要求的其他文字。符号旁应注明授权代表的姓名和地址,但如果多个符号(即授权代表、进口商、分销商等)标识了同一责任实体,则名称和地址无需重复,所有适用符号可集中排列于该地址旁边。
3.修改Annex A 条款A.4的标题为“Example of use of symbol 5.1.2
“Authorized representative”,并相应修改条款A.4内容为下:
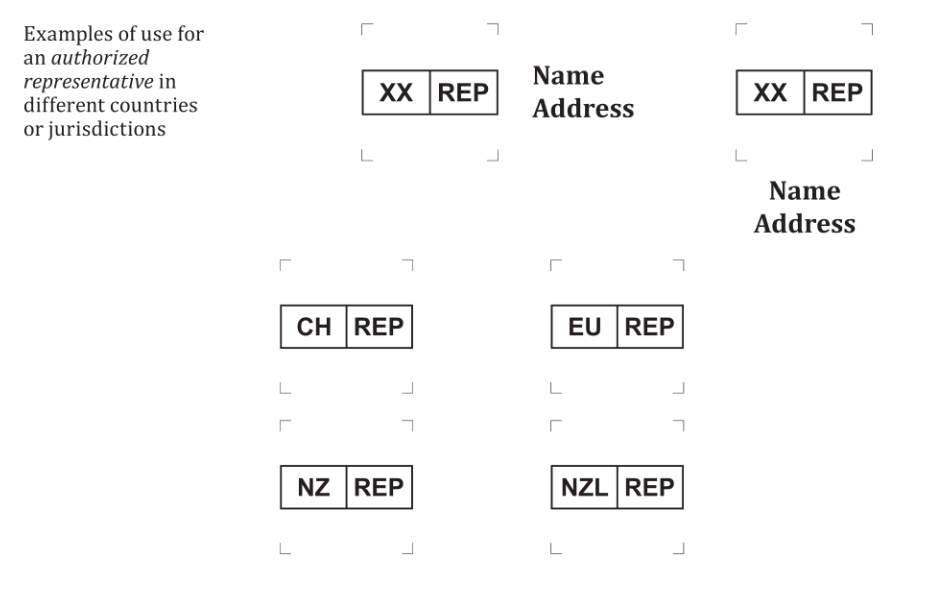 小编附上修订前的版本内容,这样各位读者便一目了然。
小编附上修订前的版本内容,这样各位读者便一目了然。
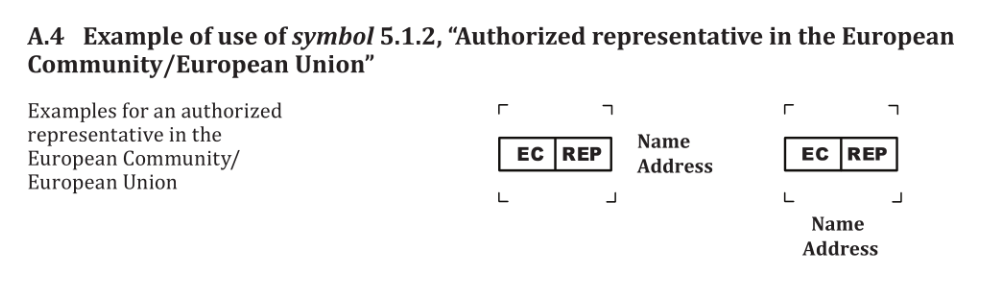 以上便是ISO 15223-1:2021/Amd1:2025更新的内容, 在此提醒计划或已经在欧盟市场销售医疗器械的制造商应提前与公告机构或欧盟授权代表沟通,适时调整产品标识以确保合规。
以上便是ISO 15223-1:2021/Amd1:2025更新的内容, 在此提醒计划或已经在欧盟市场销售医疗器械的制造商应提前与公告机构或欧盟授权代表沟通,适时调整产品标识以确保合规。



