2021年12月医械政策法规公告汇总
一、公告
1.国家药监局发布国家医疗器械监督抽检结果的通告(第5号)(2021年第105号)
为加强医疗器械监督管理,保障医疗器械产品质量安全有效,国家药品监督管理局组织对γ-谷氨酰基转移酶测定试剂(盒)、半导体激光治疗机、鼻内窥镜等18个品种进行了产品质量监督抽检,共39批(台)产品不符合标准规定。现进行通告。
原文来源:https://www.cmde.org.cn/CL0004/24640.html
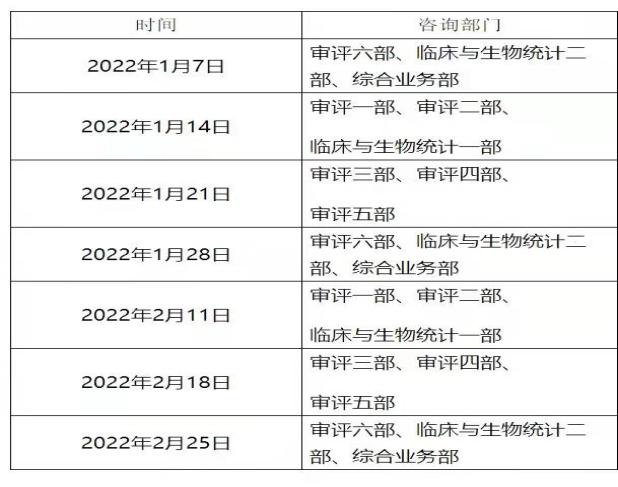
2.关于2022年1月~2月医疗器械注册受理前技术问题咨询工作安排的通告(2021年第17号)
为做好医疗器械注册受理前技术问题咨询工作,指导行政相对人安排咨询时间,保证咨询工作质量,现通告近期咨询工作安排
注:按照疫情防控要求,受理前咨询工作采用视频会议方式进行,申请人预约成功后请等待电话通知。
受理前技术问题咨询工作请申请人按照我中心2021年4月30日发布的《关于医疗器械审评检查长三角、大湾区分中心开展审评业务及器审中心咨询工作安排调整的通告》(2021年第6号)要求申请和办理。
原文来源:https://www.cmde.org.cn/CL0004/24640.html
3.国家药监局发布关于批准注册187个医疗器械产品的公告(2021年11月)(2021年第147号)
2021年11月,国家药品监督管理局共批准注册医疗器械产品187个。其中,境内第三类医疗器械产品131个,进口第三类医疗器械产品22个,进口第二类医疗器械产品32个,港澳台医疗器械产品2个(具体产品见附件)。
原文来源:https://www.nmpa.gov.cn/xxgk/ggtg/ylqxpzhzhcchpgg/20211210164643122.html
4.国家药监局关于发布YY/T 0500-2021《心血管植入物 血管假体 管状血管移植物和血管补片》等19项医疗器械行业标准的公告(2021年第144号)
YY/T 0500-2021《心血管植入物 血管假体 管状血管移植物和血管补片》等19项医疗器械行业标准已经审定通过,现予以公布。标准编号、名称、适用范围和实施日期见附件。
原文来源:https://www.nmpa.gov.cn/xxgk/ggtg/ylqxhybzhgg/20211210164312109.html
5.国家创新医疗器械特别审查申请审查结果公示(2021年第13号)
依据国家药品监督管理局《创新医疗器械特别审查程序》(国家药监局2018年第83号公告)要求,创新医疗器械审查办公室组织有关专家对创新医疗器械特别审查申请进行了审查,拟同意以下申请项目进入特别审查程序,现予以公示。
原文来源:https://www.cmde.org.cn/CL0004/24603.html
6.关于发布创新优先医疗器械注册技术审评沟通交流操作规范的通知
为进一步加强对创新医疗器械的早期介入,提高沟通交流质量,我中心根据现有工作职能对《创新优先医疗器械注册技术审评沟通交流管理规定》进行了修订,现予以发布。
原文来源:https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjylqx/20211104142753166.html
7.关于医疗器械注册申请缴纳费用有关事宜的通告(2021年第16号)
按照《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》《境内第三类和进口医疗器械注册审批操作规范》等文件规定,医疗器械、体外诊断试剂注册申请受理后,需要申请人缴纳费用的,申请人应当按规定缴纳费用。申请人未在15个工作日内缴纳费用的,视为申请人主动撤回申请,国家药品监督管理局终止其注册程序。为全面落实规定要求,现就医疗器械注册申请缴纳费用有关事宜通告如下:
原文来源:https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjylqx/20211104141907123.html
二、新发布技术指导原则
1.国家药监局发布关于荧光免疫层析分析仪等14项注册审查指导原则的通告(2021年第104号)
为加强对医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,根据《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号)和《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号),国家药品监督管理局组织制定了荧光免疫层析分析仪等14项注册审查指导原则(见附件)。现予发布。
原文来源:https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20211125173931195.html
2.国家药监局关于发布体外膜氧合(ECMO)循环套包等5项注册审查指导原则的通告(2021年 第103号)
为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局组织制定了《体外膜氧合(ECMO)循环套包注册审查指导原则》《一次性使用腹部穿刺器注册审查指导原则》《听小骨假体产品注册审查指导原则》《人工韧带注册审查指导原则》《漏斗胸成形系统产品注册审查指导原则》,现予发布。
原文来源:https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20211125173931195.html
3.国家药监局关于发布关节镜下无源手术器械产品等8项注册审查指导原则的通告(2021年 第102号)
为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局组织制定了《关节镜下无源手术器械产品注册审查指导原则》《一次性使用输尿管导引鞘注册审查指导原则》《正畸丝注册审查指导原则》《一次性使用微创筋膜闭合器注册审查指导原则》《麻醉面罩产品注册审查指导原则》《非血管腔道导丝产品注册审查指导原则》《包皮切割吻合器注册审查指导原则》《牙科脱敏剂注册审查指导原则》,现予发布。
原文来源:https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20211125173931195.html
4.国家药监局关于发布超声软组织切割止血系统同品种临床评价技术指导原则等4项技术指导原则的通告(2021年 第93号)
为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,根据《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号),国家药品监督管理局组织制定了超声软组织切割止血系统同品种临床评价技术审查指导原则等4项技术指导原则(见附件),现予发布。
原文来源:https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20211125173931195.html
5.国家药监局关于发布神经和心血管手术器械-刀、剪及针注册审查指导原则的通告(2021年第92号)
为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局组织制定了《神经和心血管手术器械-刀、剪及针注册审查指导原则》,现予发布。
原文来源:https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20211125173931195.html
三、征求意见稿
1.12月24日,国家药监局标管中心征求《医疗器械分类目录》调整意见(第二批)
根据《医疗器械分类目录动态调整工作程序》及相关要求,国家药品监督管理局医疗器械标准管理中心组织医疗器械分类技术委员会专业组研究,形成了第二批《医疗器械分类目录》内容调整意见(见附件1)。现向社会公开征求意见。
原文来源:https://www.nifdc.org.cn//nifdc/bshff/ylqxbzhgl/qxzqyj/202111091330044263.html
【全文整理】苏大卫环