一、公告
1.【CMDE】发布医疗器械优先审批申请审核结果公示(2022年第4号)
依据原国家食品药品监督管理总局《医疗器械优先审批程序》(总局公告2016年168号),我中心对申请优先审批的医疗器械注册申请进行了审核。下述项目拟定予以优先审批,现予以公示。
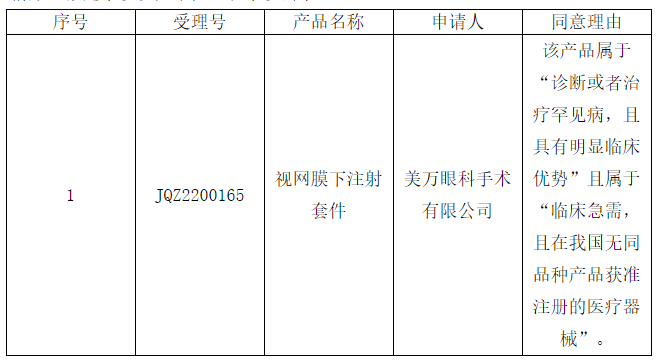
原文链接:https://www.cmde.org.cn/xwdt/zxyw/20220707163216133.html
2.【CMDE】发布创新医疗器械特别审查申请审查结果公示(2022年第5号)
依据国家药品监督管理局《创新医疗器械特别审查程序》(国家药监局2018年第83号公告)要求,拟同意以下申请项目进入特别审查程序,现予以公示。

原文链接:https://www.cmde.org.cn/xwdt/zxyw/20220616154413150.html
3.【CMDE】发布医疗器械安全和性能基本原则符合性技术指南的通告(2022年第29号)
为进一步指导注册申请人科学合理地运用《医疗器械安全和性能基本原则》进行产品研发和注册申报,确保医疗器械安全有效,国家药监局器审中心基于当前认知水平和审评工作实际情况,组织编写了《<医疗器械安全和性能基本原则>符合性技术指南》,现予发布。
原文链接:https://www.cmde.org.cn/xwdt/zxyw/20220713165731131.htm
4.【CMDE】发布《医疗器械分类目录》子目录01、04、07、08、09、10、19、21相关产品临床评价推荐路径的通告(2022年第30号)
为进一步指导注册申请人确定具体产品的临床评价路径,器审中心按照《医疗器械监督管理条例》的有关规定,根据《决策是否开展医疗器械临床试验技术指导原则》等规范要求,基于目前的审评经验以及《医疗器械分类目录》中的子目录01、04、07、08、09、10、19、21的产品描述、预期用途和品名举例,提出具体产品临床评价的推荐路径。
原文链接:https://www.cmde.org.cn/xwdt/zxyw/20220714155028153.html
5.国家药监局关于发布YY /T 1833.1-2022《人工智能医疗器械 质量要求和评价 第1部分:术语》等18项医疗器械行业标准的公告(2022年第52号)
YY /T 1833.1-2022《人工智能医疗器械 质量要求和评价 第1部分:术语》等18项医疗器械行业标准已经审定通过,现予以公布。
原文链接:https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20220706104425173.html
6.国家药监局关于批准注册193个医疗器械产品公告(2022年6月)(2022年第56号)
2022年6月,国家药品监督管理局共批准注册医疗器械产品193个。其中,境内第三类医疗器械产品139个,进口第三类医疗器械产品26个,进口第二类医疗器械产品25个,港澳台医疗器械产品3个(具体产品见附件)。
原文链接:https://www.nmpa.gov.cn/xxgk/ggtg/ylqxpzhzhcchpgg/20220715115534117.html
二、征求意见稿
1.【CMDE】公开征求《医用无针注射器注册审查指导原则(征求意见稿)》意见
根据国家药品监督管理局医疗器械注册技术指导原则制修订计划的有关要求,我中心组织起草了《医用无针注射器注册审查指导原则》,经文献调研、专题研讨等程序形成了征求意见稿(附件1),即日起在网上公开征求意见。
原文链接:https://www.cmde.org.cn/xwdt/zxyw/20220711085617159.html
2.【CMDE】征求《腹腔内窥镜手术系统技术审查指导原则 第1部分:手术器械(征求意见稿)》意见
根据国家药品监督管理局医疗器械注册技术指导原则制修订计划的有关要求,我中心组织起草了《腹腔内窥镜手术系统技术审查指导原则 第1部分:手术器械》,经文献调研、专题研讨等程序形成了征求意见稿(附件1),即日起在网上公开征求意见。
原文链接:https://www.cmde.org.cn/xwdt/zxyw/20220720161535149.html
3.【CMDE】征集参与腹腔内窥镜手术系统动物试验研究工作的相关单位信息
我中心现已形成了《腹腔内窥镜手术系统注册审查指导原则第2部分:动物试验》(初稿),为便于联系和沟通交流,中心征集参与该项指导原则研究工作的相关单位信息。欢迎相关领域的专家、学者及从业人员积极参与,提出意见和建议。
原文链接:https://www.cmde.org.cn/xwdt/zxyw/20220721145642179.html
【全文整理】苏大检测



