一、公告
1.【CMDE】发布医疗器械优先审批申请审核结果公示(2022年第5号)
依据原国家食品药品监督管理总局《医疗器械优先审批程序》(总局公告2016年168号),我中心对申请优先审批的医疗器械注册申请进行了审核。下述项目符合优先审批情形,拟定予以优先审批,现予以公示。
原文链接:
https://www.cmde.org.cn/xwdt/zxyw/20220804145314131.html
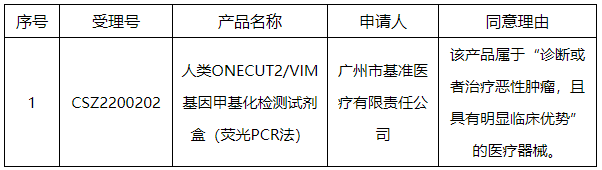
2.CMDE】发布创新医疗器械特别审查申请审查结果公示(2022年第6号)
依据国家药品监督管理局《创新医疗器械特别审查程序》(国家药监局2018年第83号公告)要求,拟同意以下申请项目进入特别审查程序,现予以公示。

原文链接:
https://www.cmde.org.cn/xwdt/zxyw/20220826140031174.html
3.【NMPA】发布《医疗器械产品注册项目立卷审查要求》等文件的通告(2022年第40号)
国家药品监督管理局医疗器械技术审评中心在受理环节按照修订后的立卷审查要求对相应申请的申报资料进行审查,对申报资料进入技术审评环节的完整性、合规性、一致性进行判断。立卷审查不对产品安全性、有效性评价的合理性、充分性进行分析,不对产品风险受益比进行判定。立卷审查适用于医疗器械注册、许可事项变更、临床试验审批等申请事项。
原文链接:
https://www.cmde.org.cn/xwdt/zxyw/20220901155926133.html
4.【NMPA】发布YY/T 0325-2022《一次性无菌导尿管》等18项医疗器械行业标准的公告(2022年第66号)
YY/T 0325-2022《一次性无菌导尿管》等18项医疗器械行业标准已经审定通过,现予以公布。标准编号、名称、适用范围和实施日期见附件。
原文链接:
https://www.nmpa.gov.cn/xxgk/ggtg/ylqxhybzhgg/20220822103954132.html
5.【NMPA】发布关于批准注册197个医疗器械产品公告(2022年7月)(2022年第65号)
2022年7月,国家药品监督管理局共批准注册医疗器械产品197个。其中,境内第三类医疗器械产品152个,进口第三类医疗器械产品20个,进口第二类医疗器械产品22个,港澳台医疗器械产品3个(具体产品见附件)。
原文链接:
https://www.nmpa.gov.cn/xxgk/ggtg/ylqxpzhzhcchpgg/20220818094757171.html
6.【NMPA】发布关于第一类医疗器械备案有关事项的公告(2022年第62号)
为做好第一类医疗器械备案工作,根据《医疗器械监督管理条例》(国务院令第739号)、《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号)、《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号),现就第一类医疗器械(含第一类体外诊断试剂)备案有关事项进行公告。
原文链接:https://www.nmpa.gov.cn/ylqx/ylqxggtg/20220811172649189.html
二、征求意见稿
1.【CMDE】公开征求《医疗器械临床评价-术语和定义》等2项行业标准意见
根据全国医疗器械临床评价标准化技术归口单位2022年关于标准制定的工作安排,我标准化技术归口单位已完成《医疗器械临床评价-术语和定义》《体外诊断试剂临床试验-术语和定义》2项行业标准征求意见稿等相关材料,建议上述2项标准发布12个月后实施,现面向社会公开征求意见。
原文链接:
https://www.cmde.org.cn/xwdt/zxyw/20220810131525190.html
2.【CMDE】公开征求《带有润滑涂层的血管介入器械注册审查指导原则(征求意见稿)》意见
根据国家药品监督管理局医疗器械注册技术指导原则制修订计划的有关要求,我中心组织起草了《带有润滑涂层的血管介入器械注册审查指导原则》,经文献调研、专题研讨等程序形成了征求意见稿(附件1),现向社会公开征求意见。
原文链接:
https://www.cmde.org.cn/xwdt/zxyw/20220823134832196.html
3.【CMDE】公开征求《经皮肠营养导管注册审查指导原则(征求意见稿)》等两项指导原则意见
根据国家药品监督管理局医疗器械注册技术指导原则制修订计划的有关要求,我中心组织起草了《经皮肠营养导管注册审查指导原则(征求意见稿)》(附件1)、《一次性使用人体动脉血样采集器注册审查指导原则(征求意见稿)》(附件2)。现向社会公开征求意见。
原文链接:
https://www.cmde.org.cn/xwdt/zxyw/20220826111515137.html
4.【CMDE】公开征求《应用纳米材料的医疗器械安全性和有效性评价指导原则 第二部分:理化表征(征求意见稿)》意见
为了规范产品技术审评,指导企业进行应用纳米材料的医疗器械产品注册申报,我中心牵头组织起草了《应用纳米材料的医疗器械安全性和有效性评价指导原则 第二部分:理化表征》,现向社会公开征求意见。请将反馈意见以电子邮件的形式于2022年9月25日前反馈我中心。
原文链接:
https://www.cmde.org.cn/xwdt/zxyw/20220831095810170.html
5. 【CMDE】公开征求《一次性使用血液分离器具注册审查指导原则(2022年修订版)(征求意见稿)》意见
根据国家药品监督管理局医疗器械注册技术指导原则制修订计划的有关要求,我中心组织修订了《一次性使用血液分离器具产品注册技术审查指导原则》(2014年第6号),形成了《一次性使用血液分离器具注册审查指导原则(2022年修订版)(征求意见稿)》(附件1),现向社会公开征求意见。
原文链接:
https://www.cmde.org.cn/xwdt/zxyw/20220901085518102.html
【全文整理】苏大检测



